синтез орг. соединений с применением магнийорг. галогенидов RMgHal (реактивов Гриньяра). Последние обычно получают по р-ции: RHal + Mg -> RMgHal. При этом р-р RHal в диэтиловом эфире медленно при перемешивании прибавляют к суспензии Mg в этом же р-рителе. Во мн. случаях (особенно при работе с ArHal) магний активируют, для чего в реакц. смесь добавляют I2, BrCH2CH2Br или С 2 Н 5 Вг. Для синтеза RMgHal из СН 2=СННа1 и ArCl вместо диэтилового эфира применяют ТГФ или др. циклич. эфиры, а также эфиры ди-и триэтиленгликоля. Из соед., содержащих подвижный атом Н (ацетилены, пиррол, индол и др.), реактив Гриньяра получают обменной р-цией, напр.: 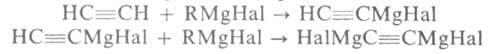
Активность RHal уменьшается в ряду: RI > RBr > RC1.
При получении реактива Гриньяра на практике применяют RBr, т. к. RC1 мало реакционноспособен, а р-ции с RI сопровождаются побочными процессами в большей степени, чем с бромидами. В случае вторичных и особенно третичных RI наблюдается отщепление HI с образованием олефина. Другая побочная р-ция, к-рая часто сопровождает синтез алкилмагнийгалогенидов,-образование углеводородов (р-ция Вюрца-Гриньяра): R'Hal + RMgHal -> RЧR' + MgHal2. В присут. каталитич. кол-в солей переходных металлов образуется обычно RЧR (р-ция Хараша).
Магнийорг. галогениды чрезвычайно реакционноспо-собны. наиб. широко их применяют в р-циях с соед., содержащими поляризованную кратную связь (напр., С=O, С 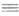 N, C=S).
N, C=S).
При взаимод. RMgHal с формальдегидом, оксидом этилена или этиленхлоргидрином образуются первичные спирты, из др. альдегидов и формиатов (эфиров)- вторичные, из кетонов, ангидридов, хлорангидридов и сложных эфиров-третичные, напр.: 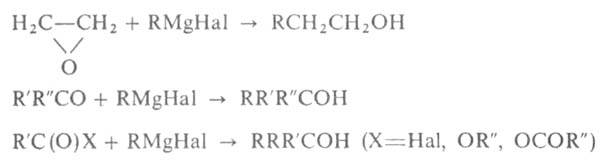
Р-цию RMgHal с ангидридами и хлорангидридами в спец. условиях используют для синтеза кетонов, напр.: 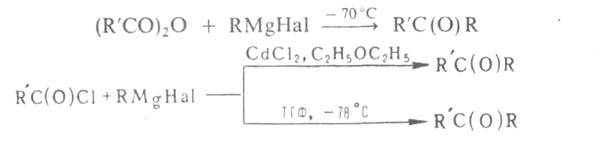
Наиб. широко для синтеза кетонов применяют амиды к-т и нитрилы: 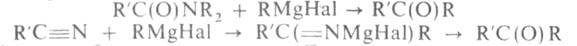
Кетоны образуются также в Г. р. с применением орто-угольных эфиров: C(OR')4 + RMgHal -> RRC(OR')2 -> RC(O)R Удобный метод синтеза альдегидов-р-ции с использованием ортомуравьиного эфира; вместо него применяют также формиаты (эфиры и соли) и формамиды (обычно N-метилформанилид): 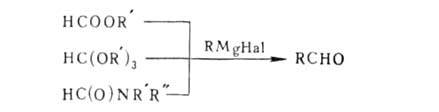
Взаимод. RMgHal с СО 2 синтезируют карбоновые к-ты, с диалкилкарбонатами и ортоугольным эфиром-эфиры и ортоэфиры карбоновых к-т.
Во мн. случаях Г. р. с карбонильными соед. протекают с количеств. выходом. Затруднения возникают при синтезе в-в с разветвленными радикалами. наиб. распространенные побочные р-ции-енолизация и восстановление, напр.: 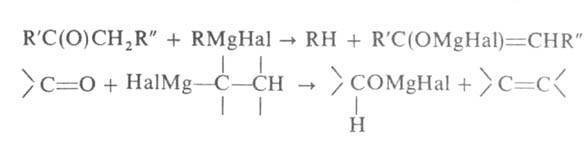
Первая р-ция может происходить, если в карбонильном соед. имеется хотя бы один  атом Н, вторая-когда у R в реактиве Гриньяра имеется атом Н в
атом Н, вторая-когда у R в реактиве Гриньяра имеется атом Н в 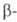 положении. Образующийся алкоголят, подобно алкоголятам А1 (см. Меервейна-Понндорфа-Верлея реакция), может реагировать как восстановитель, напр.: RRCH(OMgHal) + R'CHO -> R2CO + R'CH2OH Следствием енолизации м. б. конденсация, подобная аль-дольно-кротоновой или Клайзена, напр.:
положении. Образующийся алкоголят, подобно алкоголятам А1 (см. Меервейна-Понндорфа-Верлея реакция), может реагировать как восстановитель, напр.: RRCH(OMgHal) + R'CHO -> R2CO + R'CH2OH Следствием енолизации м. б. конденсация, подобная аль-дольно-кротоновой или Клайзена, напр.: 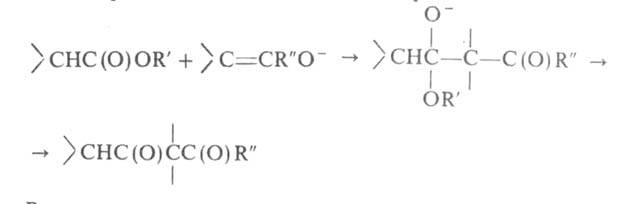
Р-ции с ароматич. кетонами часто сопровождаются образованием пинаконов. В р-циях с  непредельными карбонильными соед. возможно как 1,2-, так и 1,4-присоединение, а с ароматич. производными-и 1,6-присоединение:
непредельными карбонильными соед. возможно как 1,2-, так и 1,4-присоединение, а с ароматич. производными-и 1,6-присоединение: 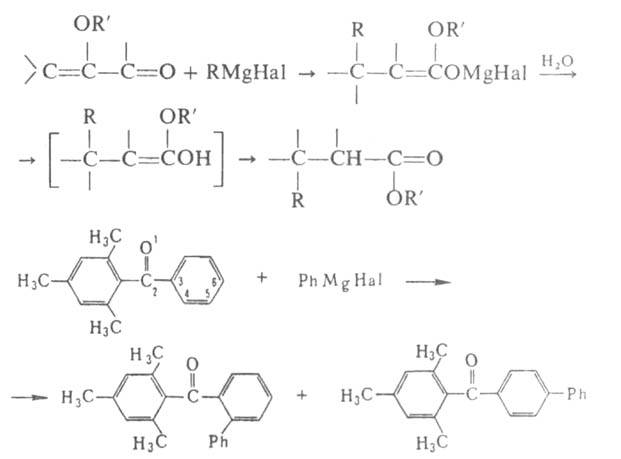
Наиб. вероятный механизм р-ции с карбонильными соед.-гетеролитический. Предполагается, что переходное состояние представляет собой квазишестичленный цикл: 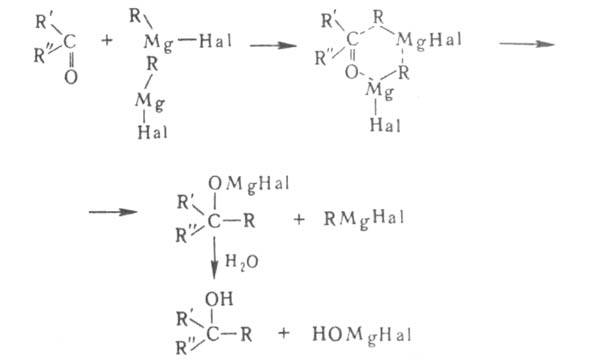
Г. р. нашла широкое применение для синтеза элементоорг. соед., напр.: RMgBr + HgBr, -> RHgBr + MgBr, RMgCl + AsCl3 - R3As + MgCl2 Взаимод. RMgHal с О 2 получают пероксиды и спирты, с HaL-алкилгалогениды, с S-сульфиды и тиолы, с Н 2 О - углеводороды.
Г. р.-один из наиб. универсальных методов синтеза орг. в-в. Реактивы Гриньяра используют также в аналит. химии, напр. для анализа в-в с подвижным атомом Н (см. Церевитинова метод). Синтез орг. соед. с использованием алкенил- и алкинилмагнийгалогенидов наз. соотв. р-цией Нормана и р-цией Иоцича.
Реактив Гриньяра впервые применил Ф. Барбье в 1899. В. Гриньяр в 1900 усовершенствовал метод, разделив р-цию на две самостоят. стадии: получение RMgHal и его взаимод. с др. реагентом.
Лит. Иоффе СТ.. Несмеянов А. Н., в кн.: Метолы элементоорганической химии. Магний. Бериллий. Кальций. Стронций. Барий, под общ. ред. А. Н. Несмеянова и К. А. Кочешкова. М.. 1963, гл. 1, 2 и 4; Реакции металлоорганических соединений как редокс-процессы. М.. 1981; Kharasch M., Reinmuth О., Grignard reactions of nonmetallic substances, N. Y4 1954. Г. А. Артамкина.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.