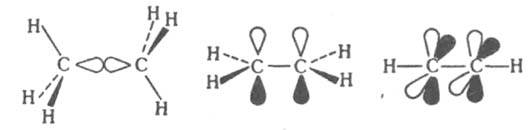
Четверная связь (и м. б. связи более высокой кратности) характерна только для переходных металлов. d-Перскрываниe ведет к образованию четверных связей в солях октагалогеиодиренат-аниона Re2Hal82-, карбоксилатах молибдена и вольфрама M(OOCR)4, внутрикомплексных соед. хрома и ванадия М 2 А 2, где А - 2,6-диметоксифенил. Энергетич. вклады, приходящиеся на связи разл. типов, неравноценны. Обычно энергия p-связи составляет в среднем около 80% энергии s-связи, а вклад d-связи оценивается, напр., в солях октахлородирснат-аниона всего в 14% от полной энергии связи. Чем выше кратность связи, тем больше ее прочность (энергия диссоциации), короче межатомное расстояние и больше силовая постоянная связи (см. табл.).

Две или больше К. с. могут образовывать в хим. соединении системы кумулированных и сопряженных связей. В первом случае две двойные связи примыкают к одному и тому же атому как, напр., в аллене Н 2 С=С=СН 2; во втором - двойные или (и) тройные связи разделены одной простой, как, напр., в 1,3-бутадиене Н 2 С=СНЧСН=СН 2 или акрилонитриле
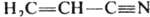 . В сопряженных системах кратность связи не м. б. определена целым числом. Мерой кратности связи (заселенности ее электронами) служит дробная величина порядка связи, расчет к-рой осуществляется обычно при помощи методов квантовой химии. Лит.: Гиллеспи Р., Геометрия молекул, пер. с англ., М., 1975; Коттон Ф. А., Уолтон Р., Кратные связи металл Ч металл, пер. с англ., М., 1985. В. И. Минкин.
. В сопряженных системах кратность связи не м. б. определена целым числом. Мерой кратности связи (заселенности ее электронами) служит дробная величина порядка связи, расчет к-рой осуществляется обычно при помощи методов квантовой химии. Лит.: Гиллеспи Р., Геометрия молекул, пер. с англ., М., 1975; Коттон Ф. А., Уолтон Р., Кратные связи металл Ч металл, пер. с англ., М., 1985. В. И. Минкин. Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.