мол. м. 128,2; бесцв. кристаллы с характерным запахом; т. пл. 80,29 °С (с возг.), т. кип. 218o С. 87,6o С/10 мм рт. ст.; d204 1,0253, d485 0,9754; п D85 1,5898; C0p 159,28 Дж/(моль . К); DH0 пл 19,288 кДж/моль, DH0 исп 43,5 кДж/моль, DH0 сгор-5158,4 кДж/моль, DH0 обр-78,53 кДж/моль; р крит 4,051 МПа, t крит 475,2 °С; e 2,85 (25 °С); m 0 (25 °С, бензол). Хорошо раств. в орг. р-рителях, плохо-в воде. Р-римость в воде: 0,019 г/л (0°С), 0,0344 г/л (25 °С). Перегоняется с водяным паром.
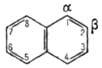
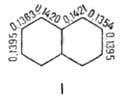
Молекула Н. плоская; в отличие от бензола, длины связей СЧС (нм) неодинаковы (см. ф-лу I).
В УФ спектре в этаноле l макс (lgel) 275 (3,75), 286 (3,60), 312 (2,40), 320 (1,40). Н. - конденсир. ароматич. углеводород. Молекула Н. представляет собой 10-p-электронную систему; электронная плотность у a-атомов С выше, чем у р-атомов. Н. обладает меньшей ароматичностью, чем бензол (см. Ароматичность). Монозамещенные Н. существуют в виде 1- и 2-изомеров. Положения 1 и 5 в нафталиновом кольце наз. ана-, положения 2 и 6 -амфи-, положения 1 и 8-пери-положениями.
Для Н. наиб. характерны р-ции электроф. замещения. Н. нитруется HNO3 в р-ре H2SO4 при 60 °С с образованием 1-нитронафталина с примесью 2-нитронафталина (1,7-4,5%); дальнейшее нитрование 1-нитронафталина при 80o С приводит к образованию смеси 1,5- и 1,8-динитронафтали-нов (1:2). Хлорирование пропусканием Сl2 в расплав Н. при 110-120°С в присут. соед. Fe приводит к образованию 1-хлорнафталина (примесь ок. 5% 2-хлорнафталина); при т-ре до 150 С получается смесь полихлоридов Н. (т. наз. галоваксы), применяемая в качестве электроизоляц. материалов. Сульфирование Н. конц. H2SO4 при т-ре ниже 80 °С приводит к 1-нафталинсульфокислоте, при т-ре выше 150°С-к 2-нафталинсульфокислоте; при действии 20%-ного олеума при 40 °С 1-нафталинсульфокислота превращ. в смесь 1,5- и 1,6-нафталиндисульфокислот, дальнейшее суль-фирование к-рых 30%-ным олеумом при 90 °С приводит к смеси 1,3,5- и 1,3,6-нафталинтрисульфокислот (см. также Нафталинсульфокислоты).
Н. легко вступает в р-цию Фриделя-Крафтса. Так, при ацетилировании в среде дихлорэтана с выходом 98% образуется 1-ацетилнафталин, в среде нитробензола - 2-ацетил-нафталин (выход 70%). Бензоилирование Н. под действием бензоилхлорида в присут. АlСl3 в среде полихлорбензолов приводит к смеси 1,5- (80%) и 1,8-(20%) дибензоилнафтали-нов. Алкилирование Н. идет обычно с низкими выходами; напр., при взаимод. Н. с СН 3 Сl при 25°С в CS2 в присут. АlСl3 с выходом 11% получается 2-метилнафталин. Н. алкилируется также в положение 2 при пропускании его смеси с алкилхлоридом над Аl2 О 3 при 400 °С. Алкилирование спиртами в присут. АlСl3 идет в b-положения с образованием смеси равных кол-в моно- и 2,6-диалкилнафталинов (выход 60-90%). Хлорметилируют Н. нагреванием с хлороформом, ледяной СН 3 СООН, Н 3 РО 4 и конц. НСl с образованием исключительно 1 -хлорметилнафталина.
Н. окисляется и гидрируется значительно легче, чем бензол. Действием Сr2 О 3 в СН 3 СООН Н. окисляется до 1,4-нафтохинона (выход 43%), КМnО 4 в воде при 100°С-до фталевой к-ты, воздухом при 350-500 °С в присут. Мо 2 О 3 или V2 О 5 -до фталевого ангидрида. При восстановлении Н. Na в С 2 Н 5 ОН в зависимости от условий проведения р-ции образуются 1,4-, 1,2-дигидронафталины или 1,2,3,4-тетра-гидронафталин ( тeтралин). При действии Na на Н. в отсутствие влаги и воздуха образуется промежут. анион-радикал зеленого цвета. При восстановлении Li в тех же условиях получается дианион красного цвета. Каталитич. гидрирова-ние Н. при 150°С (кат.-Ni) приводит к тетралину, при 200 °С - к декагидронафталину ( декалину). Декалин образуется также при гидрировании Н. при 120-180°С на платиновом катализаторе.
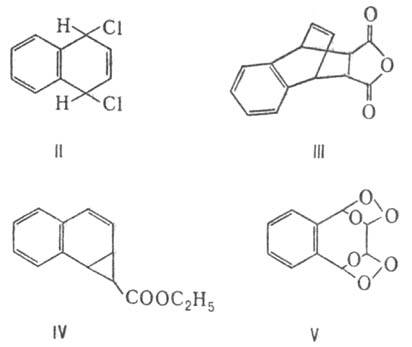
Н. при нормальной или пониженной т-ре в отсутствие катализатора присоединяет Сl2 с образованием соед. II. С малеиновым ангидридом при 100°С и давлении 103 МПа Н. дает аддукт III с выходом 78%; причем в случае алкилнафта-линов атака проходит по замещенному кольцу. Известны также аддукты Н. с диазоуксусным эфиром (IV) и озоном (V).
Н. содержится в кам.-уг. смоле (ок. 10%) и нефти; напр., в нефти о. Борнео 6-7% Н. В пром-сти Н. выделяют охлаждением фракции кам.-уг. смолы с т. кип. 210-220°С (т. наз. нафталинового масла); кристаллический Н. отделяют от примесей центрифугированием, очищают промывкой H2SO4 (от тиофена) и разб. щелочью (от фенола), перегоняют. Из нефти Н. выделяют при переработке масла, получаемого каталитич. риформингом бензина. Масло, содержащее Н. и алкилнафталины, перегоняют, подвергают гидродеалкили-рованию при 700 °С под давлением (1-5 МПа) или при 550-650 °С в присут. смеси оксидов Со и Мо; сырой Н. перегоняют.
Количеств. определение Н. основано на образовании пик-рата, т. пл. 151 С; содержание Н. в моторном топливе определяют по спектру поглощения в УФ области.
Н.-исходный продукт в произ-ве фталевого ангидрида, декалина, тетралина, нафтолов, иафтиламинов и др., промежуточный - в произ-ве азокрасителей, пластификаторов, разбавителей, ПАВ, лек. ср-в; применяют в качестве инсектицида, напр, для борьбы с молью. ПДК в воздухе 20 г/м 3, КПВ 1,7-8,2%.
Лит.: Ворожцов Н. Н., Основы синтеза промежуточных продуктов и красителей, М., 1955; Доналдсон Н., Химия и технология соединении нафталинового ряда, пер. с англ., М., 1963; Клар Э., Полициклические углеводороды, пер. с англ., т. 1, М., 1971, с. 209; Ullmanns Encyklopadie, 4 Aufl., Bd. 17, Weinheim, 1979; Kirk-Othmer encyclopedia, 3 ed., v. 15, N.Y., 1981, p. 698 719.
Н. Н. Артамонова.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.