эфиры азотистой к-ты HNO2. Содержат одну или неск. групп ЧОЧN=O, связанных ковалентной связью с атомом углерода орг. радикала. Низшие алкилнитриты-газы, остальные - бесцв. или желтоватые жидкости, не раств. в воде, смешиваются с обычными орг. р-рителями. Н. о. более летучи, чем изомерные им нитросоединения. Физ. св-ва нек-рых Н. о. приведены в таблице.
СВОЙСТВА НЕКОТОРЫХ ОРГАНИЧЕСКИХ НИТРИТОВ

* При 21 °С. ** При 22 °С.
Вращение вокруг связи ОЧN заметно заторможено (барьер вращения DG* 34 кДж/моль), поэтому s-цuc- и s- траc -конформеры спектрально различимы. ИК спектр Н. о. имеет характеристич. полосы 1613-1625 и 1653-1681 см -1 (N=O) соотв. для s-цис- и s-транс- форм. В УФ спектрах l макс 220 нм (e 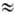 2.103) и 340-385 нм (e
2.103) и 340-385 нм (e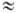 70-80), соответствующие p
70-80), соответствующие p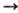 p*- и п
p*- и п 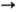 p*-переходам. В спектрах ЯМР 14N и 15N хим. сдвиг атома N d 200-250 м. д. (относительно CH3NO2).
p*-переходам. В спектрах ЯМР 14N и 15N хим. сдвиг атома N d 200-250 м. д. (относительно CH3NO2).
При комнатной т-ре Н. о. медленно разлагаются, на свету низшие Н. о. могут взрываться. В кислой среде легко гидро-лизуются; это позволяет использовать Н. о. в качестве мягких нитрозирующих агентов (для получения малостабильных солей диазония, дезаминирования алкиламинов, нитро-зирования фенолов и СН-кислот и т. п.). И. о., имеющие активир. атом Н при b-углеродном атоме, могут отщеплять HNO2, напр.:
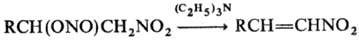
При действии N2O5 H.o. окисляются в нитраты, при действии гидразина или LiAlH4 восстанавливаются в соответствующие спирты. Н. о., содержащие в молекуле более трех атомов С, претерпевают фотохим. перегруппировку в нитрозосоед. ( Бартона реакция), напр.:
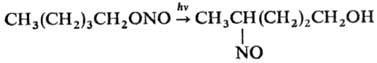
Р-ция идет стереоселективно и используется для введения функц. групп в неактивные участки сложных молекул, напр. стероидов.
Получают Н. о. взаимод. спиртов с разл. нитрозирующи-ми агентами [NaNO2/H3SO4, NaNO2/Al2(SO4)3, оксиды азота, NOCl/пиридин, NOBF4] или взаимод. алкилгало-генидов с солями HNO2 (наряду с нитросоед.).
Н. о.- высокотоксичные соединения. Этил- и пентилнитри-ты учащают пульс, понижают кровяное давление, окисляют гемоглобин в метгемоглобин. Н. о. обладают сосудорасширяющим и спазмолитич. действием. Изопентилнитрит - противоядие при отравлении синильной к-той и ее солями.
H.о.-полупродукты в орг. синтезе.
Лит.: Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 440-45; Houben- Weil, Methoden der organischen Chemie, Bd 6, Tl 2, Stuttg., 1963, S. 325-62.
С. Л. Иоффе.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.