группа инсектицидов, синтетич. аналогов прир. пиретринов, к к-рой относят соед., сходные с ними по характеру и механизму физиол. действия, но иногда существенно различающиеся по хим. строению.
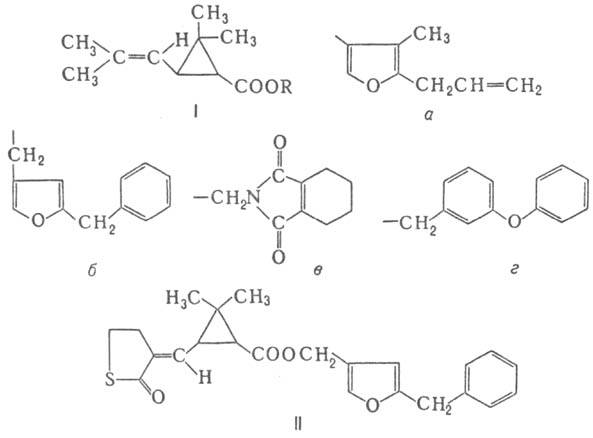
Наиб. изучены эфиры хризантемовой к-ты (т. наз. П. первого поколения; ф-ла I), напр. аллетрин (R = а), ресмет-рин (R = б), тетраметрин (R = в), фенотрин (R = г). Соед. обладают высокой инсектицидной активностью, но, как и прир. пиретрины, легко окисляются на свету и поэтому используются гл. обр. в закрытых помещениях против бытовых насекомых. Таким же действием обладает каде-трин (II).
Более стабильны к окислению П. второго поколения-эфиры 3-(2,2-дигалогенвинил)-2,2-диметилциклопропанкар-боновых к-т, напр. перметрин (III; X = Y = Cl, R = H), ЛД 50 450 мг/кг (крысы); циперметрин (III; X = Y = Cl, R = CN), ЛД 50 200 мг/кг; дельтаметрин (III; X = Y = Br, R = CN), ЛД 50 128 мг/кг; а также фенвалерат (IV; R = 4-ClC6H4), ЛД 50 451 мг/кг.
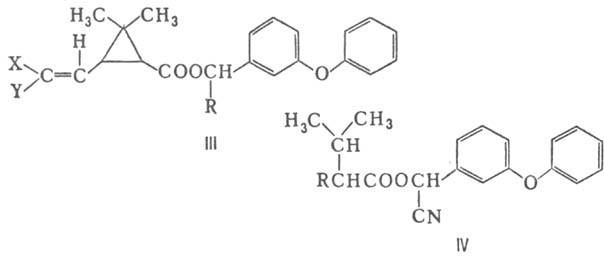
Эти соед. обладают широким спектром действия, эффективны при очень малых нормах расхода - обычно от 16 до 300 г/га, а для дельтаметрина, самого активного из совр. инсектицидов, норма расхода 5-20 г/га. Их используют для обработки хлопчатника, а также для мн. других с.-х. культур и садов. Перметрин, кроме того, находит применение против бытовых насекомых, для обработки тканей и тарных материалов.
Недостатки описанных П.-высокая токсичность для пчел и рыб, отсутствие системного действия и непригодность для борьбы с почвообитающими насекомыми.
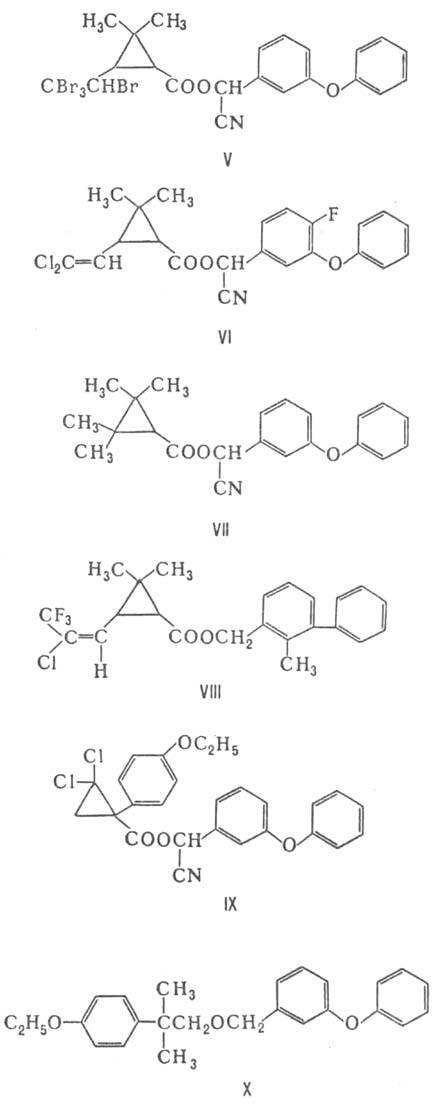
Предложены П. третьего поколения. К ним относятся цигалотрин (III; X = CF3, Y = Cl, R = CN), флуцитринат (IV; R = 4-CHF2OC6H4) и флувалинат (IV, R = 2-Cl-4CF3C6H3NH), а также тралометрин (V), цифлу-трин (VI), фенпропатрин (VII), бифетрин (VIII), циклопро-трин (IX; ЛД 50 5000 мг/кг) и этофенпрокс (X), к-рый в отличие от других П. не содержит сложноэфирной группы. Нек-рые из этих П. обладают высокой активностью против клещей, меньшей токсичностью для пчел, птиц и рыб.
П.-инсектициды контактного и кишечного действия. Они очень быстро всасываются в организм через наружные покровы и нарушают процессы передачи нервных импульсов, вызывая паралич и гибель насекомых.
Инсектицидная активность П. зависит от их стереохим. конфигурации и изомерного состава. Не все изомеры равноценны по активности и токсичности. Так, для П. ф-л IV-VII наиб. активны соед. с 5-конфигурацией a-циано-3-феноксибензильной группировки (у соед. с R-конфигура-цией инсектицидная активность резко падает или вообще исчезает). Как правило, П. получают в виде смеси изомеров с преобладанием наиб. активного.
Доля П. на мировом рынке инсектицидов в 1987 составила 22% (по сравнению с 1% в 1976).
Лит.: Мельников H. H., Пестициды. Химия, технология и применение, M., 1987, с. 170 91, Ca s id a J. E., "Environmental Health Perspectives", 1980, v. 34, p. 189 202; Naumann К., в кн.: Chemie der Pflanzenschutz-und Schadhngsbe-kampfungsmittel, Bd 7, hrsg. von R. Wegler, В. Heidelberg N. Y., 1981; The pyre-throid insecticides, ed. by J. P. Leahey, L. Phil., 1985. Г. С. Швиндлерман.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.