полимеры, в макромолекулах к-рых содержатся ионогенные группы. В р-ре макромолекула П.-полиион, окруженный эквивалентным кол-вом про-тивоионов (малых ионов с зарядами противоположного знака). Размеры полииона на неск. порядков больше, чем противоионов.
Различают поликислоты, полиоснования и полиамфо-литы. Сильные П. в водных р-рах полностью ионизованы независимо от значения рН. Сильные поликислоты содержат сульфо-, сульфатные или фосфатные группы, напр. поливинилсульфокислота [ЧCH2CH(SO3H)Ч]n, сильные полиоснования-четвертичные аммониевые группы, напр. ионены:
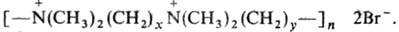
Заряд слабых поликислот и полиоснований определяется величинами констант диссоциации Кионогенных групп и существенно зависит от рН р-ра. Типичные слабые поликислоты содержат карбоксильную группу, напр. полиакриловая кислота[ЧСН 2 СН(СООН)Ч] и, слабые полиоснования - первичные, вторичные, третичные аминогруппы, способные протонироваться в водных средах, напр, цоливи-ниламин [ЧCH2CH(NH2 )Ч]n, поливинилпиридины. Поли-амфолиты содержат как кислотные, так и основные группы. Суммарный заряд полиамфолитов при изменении рН р-ра может менять знак; значение рН, при к-ром он равен нулю, наз. изоэлектрич. точкой рI. Полиамфолитами являются белки и нуклеиновые к-ты.
П. могут быть как линейными, так и пространственно сшитыми (о последних см. Ионообменные смолы).
Конформации в растворах. Из-за наличия кулоновских взаимодействий (отталкивания одноименно заряженных групп в макромолекуле и притяжения противоионов к полииону) поведение водных р-ров линейных П. существенно отличается от поведения как неионогенных (незаряженных) полимеров (см. Растворы полимеров), так и низкомол. электролитов (см. также Растворы электролитов). Благодаря электростатич. отталкиванию между одноименно заряженными ионогенными группами макромолекула П. стремится развернуться и приобрести более асимметричную форму по сравнению с формой статистич. клубка, характерной для незаряженных цепей. Поэтому в р-рах полиионы имеют значительно большие размеры и асимметрию, чем макромолекулы той же хим. природы, но лишенные заряда. Эта особенность П. обнаруживается при вискозиметрич., седиментац. и диффузионных исследованиях, при изучении явлений переноса в р-рах П. в электрич. полях, напр. электрофореза и электропроводности.
Размеры полииона в водных р-рах сильно зависят от линейной плотности заряда (величины заряда П., приходящейся на единицу его контурной длины). Так, при диссоциации всех карбоксильных групп высокомол. полиакриловой к-ты объем, занимаемый таким полиионом в разб. бессолевом водном р-ре, увеличивается более чем на два порядка по сравнению с объемом макромолекулы полиакриловой к-ты, в к-рой все карбоксильные группы находятся в протонир. форме ЧСООН. Разворачивание цепи П. проявляется в прогрессирующем возрастании приведенной вязкости (h пр = h уд/ с, где h уд -уд. вязкость) бессолевого водного р-ра П. при уменьшении его концентрации с(полиэлектролитный эффект), в то время как для р-ров неионогенных макромолекул характерно линейное уменьшение h пр при разбавлении. Объясняется этот эффект тем, что при разбавлении р-ров П. увеличивается объем. в к-ром распределяются противоионы, экранирующие кулоновское отталкивание между фиксир. зарядами полииона, вследствие чего возрастает их отталкивание и происходит прогрессирующее разворачивание полииона.
Конформация П. определяется также наличием в р-ре низкомол. электролитов, напр. простых (1,1-валентных) солей. Введение их в р-р приводит к экранированию зарядов полииона и уменьшению электростатич. отталкивания между ними, а следовательно, и степени разворачивания полииона, зависящей от концентрации низкомол. электролита. При значит. концентрациях солей (порядка 1 М) вклад кулоновских взаимодействий в разворачивание цепей исчезает и их размеры совпадают с размерами неионогенных цепей той же хим. природы. Дальнейшее введение низкомол. электролитов в р-ры П. может привести к выделению П. в отдельную, чаще всего жидкую фазу (высаливание).
Изменение конформации макромолекул П. необходимо учитывать при изучении зависимости св-в р-ров П. от их концентраций. В этих случаях обычно используют режимы разбавлений, при к-рых ионная сила р-ра остается неизменной,-т. наз. изоионное разбавление. Наилучшие результаты дает метод диализа р-ров П. разл. концентраций против общего водного р-ра простой соли. Часто измерения проводят при высоких концентрациях простых солей, достаточных для эффективного экранирования кулоновских взаимодействий.
Полиамфолиты в изоэлектрич. точке имеют компактную конформацию, стабилизированную кулоновским притяжением между противоположно заряженными группами. Поэтому экранирование электростатич. взаимод. при введении в р-р низкомол. солей сопровождается разворачиванием макромолекул.
Электрохимические свойства растворов. Последние резко отличаются от св-в р-ров низкомол. электролитов. Полимерные к-ты и основания заметно слабее своих низкомол. аналогов, и в противоположность последним их значения Кне являются характеристич. величинами, но зависят от степени диссоциации П. (a). Способность поликислоты отщеплять протон, а полиоснования присоединять его ослабляется при увеличении a (т. е. величины заряда полииона) из-за прогрессирующего возрастания кулоновского взаимод. между полиионом и противоионами (напр., в случае поли-кислоты диссоциирующий протон с увеличением a испытывает все большее притяжение со стороны полииона и работа отрыва протона возрастает). Этот эффект существенно уменьшается при введении в р-ры простых солей, экранирующих заряды полиионов. По мере увеличения концентрации простых солей электрохим. поведение р-ров слабых П. приближается к поведению низкомол. аналогов.
Для описания электрохим. поведения П. пользуются значением "характеристич." константы диссоциации К 0,т. е. диссоциации единичной ионогенной группы в отсутствие др. заряженных групп в цепи, к-рую получают экстраполяцией К. к нулевому значению a, и производной "кажущейся" K каж по a. Значения К 0 и Кдля соответствующего низкомол. аналога обычно близки, хотя они и не должны совпадать, т. к. ионогенная группа в полимерной цепи находится в др; микроокружении. Изменение K каж П. при изменении a определяется производной электростатич. своб. энергии G эл по а:
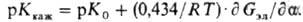
Для изучения силы полимерных к-т и оснований не следует пользоваться определением рКкак значением рН в точке a = 0,5. Поскольку G эл зависит от конформации цепи, методы изучения равновесия при диссоциации (потен-циометрич. титрование) широко используют для определения G эл и исследования термодинамики конформац. превращений в р-рах П. (белков, нуклеиновых к-т, полисахаридов, полиметакриловой к-ты и др.).
Равновесные свойства растворов. Изучение равновесных с-в р-ров П. свидетельствует о существ. отклонении их поведения от идеального. Так, осмотич. давление p бессолевых р-ров П. значительно меньше, чем ожидаемое для идеальных р-ров (p ид). Мерой отклонения от идеального поведения служит величина осмотич. коэф. Ф р =>p/p ид, к-рая для высокомолекулярных П. не зависит от их мол. массы и концентрации в р-ре, но заметно уменьшается при возрастании линейной плотности заряда. Для типичных П. винилового ряда Ф р ~ 0,1. Главной причиной отклонения поведения р-ров П. от идеального считают влияние сильного электрич. поля полииона на характер распределения противоионов. К таким же выводам приводит анализ значений коэф. активности противоионов в р-рах П.
Совр. теории р-ров П. опираются на представление о том, что при высокой линейной плотности заряда часть противоионов должна "сконденсироваться" на полиионе, чтобы понизить плотность заряда до нек-рой критич. величины. Последняя совпадает с обратной величиной бьеррумовской длины e2/>ekT (е-заряд протона, e-диэлектрич. проницаемость р-рителя, k- постоянная Больцмана, Т-абс. т-ра). Если отношение x = (
При изучении равновесных св-в р-ров П. различают бессолевые р-ры и р-ры, содержащие дополнительно введенные соли. В первом случае вклад собственно полиионов в равновесные (коллигативные) св-ва р-ра П. пренебрежимо меньше, чем вклад большого кол-ва противоионов. Поэтому бессолевые р-ры не используют для определения мол. масс П. Введением в р-ры П. дополнит. кол-в солей удается, опираясь на аддитивность p в такой тройной системе (p= = p п + p: с, где p п - измеряемое осмотич. давление бессолевого р-ра П., p с -осмотич. давление р-ра соли, не содержащего П.), выявить экспериментально вклад полиионов. При исследовании мембранного равновесия в солевых р-рах П. обнаруживается т. наз. доннановский эффект исключения соли. Он обусловлен установлением равновесного распределения соли, при к-ром активности соли в ячейке, содержащей П., и в отделенной от нее полупроницаемой мембранной ячейке, не содержащей П., совпадают. Отсюда вытекает, что концентрация соли в первой ячейке меньше, чем во второй, т. е. со ль действительно частично исключается из ячейки, содержащей П.; это относится и к распределению соли в разб. р-ре П. между пространством, занятым звеньями полииона, |и окружающим р-рителем. При увеличении концентрации соли доннановский эффект ослабляется и при больших концентрациях им можно пренебречь.
Совр. теории р-ров П. позволяют рассчитать электро-статич. потенциал в близи заряженного полииона и G эл, эквивалентную работе, совершаемой против электрич. сил при диссоциации П., имеющего заданное пространств. расположение ионогенных групп, т. е. заданную конформацию. Большинство из этих теорий является распространением теории Дебая -Хюккеля на многозарядные полионы. Характеристики рассчитывают для полиионов определенной геом. формы, к-рые являются моделями реальных макромолекул. Так, сферич. модели используют для предсказания св-в компактных полиионов, напр. глобулярных белков, модели цилиндров и жестких стержней - для жестких макромолекул, напр. нативной ДНК, или для изучения равновесных свойств р-ров синтетических П. Разворачивание полиионов анализируют в терминах моделей эквивалентных статистич. цепей.
П. обладают способностью специфически связывать про-тивоионы (образование ионных пар между заряженными группами П. и противоионами, ионных тройников и более сложных ионных комплексов). Это явление не находит объяснения в рамках простых электростатич. теорий П. и связано с особенностями строения ионогенных групп П. и гидратных оболочек противоионов. Многие П. способны образовывать устойчивые комплексы с многозарядными ионами и ионами переходных металлов.
Применение. П. используют как флокулянты в процессах обогащения минер. сырья, в-ва для стабилизации буровых жидкостей и повышения нефтеотдачи, стабилизаторы коллоидных систем в пищ. и парфюм. пром-сти, ср-ва для снижения жесткости воды, добавки к ПАВ, для улучшения св-в волокон и бумаги, для решения экологич. задач, напр. для очистки пром. бытовых стоков; в медицине П.-эффективные физиологически активные соед., напр. при конструировании высокоактивных искусств. антигенов и создании на их основе вакцин. П. используют для получения полимер-полимерных комплексов.
Лит.: Тенфорд Ч., Физическая химия полимеров, пер. с англ., М., 1965; Энциклопедия полимеров, т. 3, М., 1977, с. 89-101; Polyelectrolytes, ed. by Е. Selegny [а. о.], Dordrecht Boston, 1974; Polyelectrolytes and their applications, ed. by A. Rembaum, E. Selegny, Dordrecht - Boston, 1975. А. Б. Зезин
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.