твердых тел, гетерогенное физ.-хим. взаимод. твердого тела и жидкости, сопровождающееся переходом твердой фазы в р-р; один из осн. процессов хим. технологии. Р. следует отличать от экстрагирования, при к-ром контактирующие с р-ром твердые частицы состоят из двух или более р-римых и инертных твердых фаз, а Р. носит избират. характер (см. также Выщелачивание).
Различают физическое, химическое и электрохимическое Р. При физическом Р. переход в р-р в-ва не сопровождается изменением его хим. состава; в-во можно выделить в твердом состоянии с помощью выпаривания и кристаллизации. При химическом Р. переход в-ва в р-р сопровождается хим. р-цией; исходное в-во нельзя выделить из р-ра в твердом состоянии физ. методами (примеры-Р. металлов или их оксидов в к-тах, Р. фосфоритов либо апатитов в сернокислотном р-ре с получением Н 3 РО 4 и др.). Электрохимическое Р. протекает в условиях, когда процессу сопутствует перенос электрич. зарядов. Наиб. изучены закономерности и практика Р. твердых в-в с ионной кристаллич. решеткой (гл. обр. соли), к-рым в осн. посвящена данная статья.
Физико-химические основы процесса
Р. сопровождается поглощением или выделением теплоты. Тепловой эффект Р. находят по ур-нию: DH р = U Ч ЧDH г(с), где 17- энергия кристаллич. решетки растворяемой соли, DH г(с) - теплота гидратации (сольватации) перешедших в р-р ионов соли. При U >DH г(с) и DH р > 0 процесс эндо-термичсн; при U <DH г(с) и DH р > 0 процесс экзотермичен. Условия самопроизвольного протекания процесса определяются знаком величины DG, к-рую вычисляют по выражению: DG = DH р Ч TDS, где Т-абс. т-ра; DS-изменение энтропии. При DG < 0 вероятно Р., при DG > 0 вероятен обратный процесс-кристаллизация. Расчет может дать положит. либо отрицат. результат (отсутствие или наличие растворимости).
При нек-рой концентрации, наз. концентрацией насыщения с н, между твердым телом и жидкостью устанавливается равновесие. При нем хим. потенциал в-ва в р-ре становится равным хим. потенциалу того же в-ва в твердом состоянии. Концентрация с н не зависит от давления, однако в значит. степени определяется т-рой, с увеличением к-рой р-римость возрастает. Последняя оказывает сильное влияние на кинетику Р. С увеличением р-римости возрастает разность концентраций (движущая сила процесса) и Р. ускоряется (см. также Растворы).
Физическое Р. может протекать по диффузионному, кине-тич. или смешанному механизму (см. Массообмен). Рассмотрим наиб. распространенный диффузионный механизм. При Р. на пов-сти растворяющегося тела возникает диффузионный пограничный слой, в пределах к-рого концентрация изменяется от с н на пов-сти тела до концентрации св осн. массе р-ра. При погружении тела в неподвижную жидкость в пределах диффузионного слоя возникает движение жидкости, побуждаемое разностью плотностей ее и тела в слое и вне его (естеств. конвекция). При погружении тела в движущуюся жидкость в пределах диффузионного слоя также возникает движение, скорость к-рого снижается по мере приближения к пов-сти тела (вынужденная конвекция, ускоряемая перемешиванием). При этом толщина слоя зависит от его диффузионных и гидродинамич. параметров и уменьшается с увеличением числа Рейнольдса Re = ud/v (u-скорость обтекания жидкостью объекта P., d-eгo размер, v-кинематич. вязкость жидкости).
Осн. закон кинетики .диффузионного P.: ЧdM/dt == kF(c н Ч с), где М-масса растворяющегося в-ва, t-время, k-коэф. массоотдачи, F-площадь пов-сти Р. Параметр kопределяется ур-ниями в обобщенных переменных (табл.; см. Подобия теория).
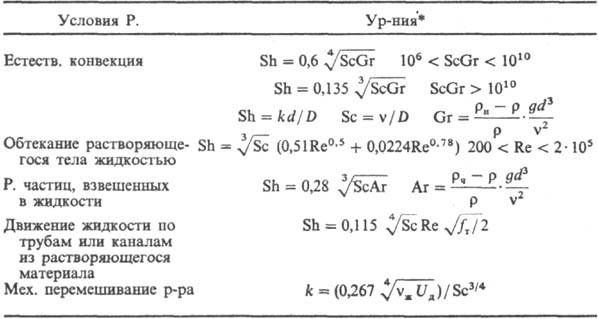
* Обозначения: D-коэф. диффузии; g- ускорение своб. падения; r-плотн. р-ра; r н -плотн. насыщ. р-ра; r ч -плотн. твердых частиц; f т - коэф. трения; U д = = N/rV ж -среднее значение диссипации энергии в единице массы перемешиваемой жидкости; N = x r w3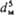 - мощность, затрачиваемая на перемешивание; V ж -объем жидкости в аппарате; w-частота вращения мешалки; d м- диаметр окружности, описываемой мешалкой; 4-коэф. сопротивления вращению мешалки.
- мощность, затрачиваемая на перемешивание; V ж -объем жидкости в аппарате; w-частота вращения мешалки; d м- диаметр окружности, описываемой мешалкой; 4-коэф. сопротивления вращению мешалки.
Химическое Р. может протекать без образования или с образованием новой фазы.
Р. без образования новой фазы (продукты р-ции растворены в жидкости). Скорость процесса находят из выражения:
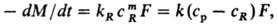
где
-dM/dt = Fcp/(>1R+>1/k).
Аналогично физическому Р. в данном случае также различают диффузионный, кинетич. и смешанный механизмы.
Р. с образованием новой твердой фазы. Возможно неск. вариантов процесса.
1) Твердый продукт р-ции немедленно удаляется с пов-сти Р.; при этом скорость процесса остается постоянной (при F =const и с =const).
2) Твердый продукт образует пленку с постоянной по толщине пористостью, плотно связанную с исходным твердым материалом. По мере протекания процесса толщина пленки возрастает, а скорость процесса снижается. Анализ кинетики Р. сферич. частиц (наиб. распространенный случай) в описанных условиях приводит к выражению:
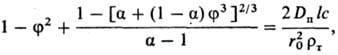
где f = r/r0; a = m'(r т/r п); r0, r-начальный и текущий радиусы растворяющейся сферы из исходного в-ва; r т, r п -плотн. в-ва и продуктов р-ции; D п -коэф. диффузии в-ва сквозь пленку продуктов; l, m'-стехиометрич. коэф. пересчета от исходного в-ва к реагенту и от продуктов р-ции к растворяющемуся в-ву.
3) Образующаяся твердая фаза кристаллизуется в р-ре, что обусловлено его пересыщением, и осаждается на пов-сти Р. Ее экранирование тем значительнее, чем выше концентрация твердых частиц в р-ре.
Р. с образованием газообразной фазы встречается особенно часто (Р. металлов в к-тах и разложение ими карбонатов или сульфитов с выделением Н 2, СО 2 или SO2). Газообразные продукты оказывают сильное, иногда определяющее влияние на химическое Р.: изолируют от жидкого реагента пов-сть р-ции и способствуют хорошему перемешиванию р-ра вблизи этой пов-сти благодаря выделению газовых пузырьков. Интенсивность пузырькового режима, число пузырьков и частота их образования зависят от концентрации реагента. С ее увеличением возрастает константа скорости
Для мн. объектов Р. в условиях газовыделения протекает в диффузионной области; закономерности изменения конста. нты
Опытные данные по кинетике Р. ряда объектов обобщены критериальными ур-ниями, к-рые применимы к концентрациям, не превышающим критические:
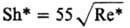 Sc < 300
Sc < 300 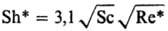 Sc>300 10-3<Re*<102
Sc>300 10-3<Re*<102
Sh* = (
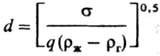 Sс=u ж/
Sс=u ж/
где s-поверхностное натяжение жидкости; R
-плотн. потока реагента к пов-сти Р.; l-стехиометрич. коэффициент. Обобщение выполнено с учетом результатов экспериментов по P. Mg, Мn, СаСО 3, СuСО 3
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.