Понятие об этой величине претерпевало длительные изменения в соответствии с изменением представления об атомах. Согласно теории Дальтона (1803), все атомы одного и того же химического элемента идентичны и его атомная масса - это число, равное отношению их массы к массе атома некоего стандартного элемента. Однако примерно к 1920 стало ясно, что элементы, встречающиеся в природе, бывают двух типов: одни действительно представлены идентичными атомами, а у других атомы имеют одинаковый заряд ядра, но разную массу; такие разновидности атомов были названы изотопами. Определение Дальтона, таким образом, справедливо только для элементов первого типа. Атомная масса элемента, представленного несколькими изотопами, есть средняя величина из массовых чисел всех его изотопов, взятых в процентном отношении, отвечающем их распространенности в природе. В 19 в. в качестве стандарта при определении атомных масс химики использовали водород или кислород. В 1904 за стандарт была принята 1/16 средней массы атома природного кислорода (кислородная единица) и соответствующая шкала получила название химической. Масс-спектрографическое определение атомных масс проводилось на основе 1/16 массы изотопа 16О, и соответствующая шкала называлась физической. В 1920-х годах было установлено, что природный кислород состоит из смеси трех изотопов: 16О, 17О и 18О. В связи с этим возникли две проблемы. Во-первых, оказалось, что относительная распространенность природных изотопов кислорода немного варьирует, а значит, в основе химической шкалы лежит величина, не являющаяся абсолютной константой. Во-вторых, у физиков и химиков получались разные значения таких производных констант, как молярные объемы, число Авогадро и др. Решение вопроса было найдено в 1961, когда за атомную единицу массы (а.е.м.) была принята 1/12 массы изотопа углерода 12С (углеродная единица). (1 а.е.м., или 1D (дальтон), в СИ-единицах массы составляет 1,66057Ч10-27 кг.) Природный углерод также состоит из двух изотопов: 12С - 99% и 13С - 1%, но новые величины атомных масс элементов связаны только с первым из них. В результате была получена универсальная таблица относительных атомных масс. Изотоп 12С оказался удобным и для физических измерений.
МЕТОДЫ ОПРЕДЕЛЕНИЯ
Атомную массу можно определить либо физическими, либо химическими методами. Химические методы отличаются тем, что на одном из этапов в них фигурируют не сами атомы, а их комбинации.
Химические методы. Согласно атомной теории, числа атомов элементов в соединениях относятся между собой как небольшие целые числа (закон кратных отношений, который открыт Дальтоном). Поэтому для соединения известного состава можно определить массу одного из элементов, зная массы всех других. В некоторых случаях массу соединения можно измерить непосредственно, но обычно ее находят косвенными методами. Рассмотрим оба этих подхода. Атомную массу Al недавно определили следующим образом. Известные количества Al были превращены в нитрат, сульфат или гидроксид и затем прокалены до оксида алюминия (Al2O3), количество которого точно определяли. Из соотношения между двумя известными массами и атомными массами алюминия и кислорода (15,9)
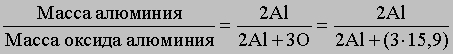
нашли атомную массу Al. Однако прямым сравнением с атомной массой кислорода можно определить атомные массы лишь немногих элементов. Для большинства элементов их определяли косвенным путем, анализируя хлориды и бромиды. Во-первых, эти соединения для многих элементов можно получить в чистом виде, во-вторых, для их точных количественных определений в распоряжении химиков имеется чувствительный аналитический метод, основанный на сравнении их масс с массой серебра. Для этого точно определяют массу анализируемых соединений и массу серебра, необходимого для взаимодействия с ними. Атомную массу нужного элемента рассчитывают исходя из атомной массы серебра - эталонной величины в подобных определениях. Атомную массу серебра (107,870) в углеродных единицах определяли косвенным химическим методом.
Физические методы. В середине 20 в. существовал только один физический метод определения атомных масс, сегодня наиболее широко применяют четыре.
Плотность газа. Самый первый физический метод основывался на определении плотности газа и на том, что в соответствии с законом Авогадро равные объемы газов при одинаковых температуре и давлении содержат одинаковое число молекул. Следовательно, если определенный объем чистого СО2 имеет массу, в 1,3753 большую, чем такой же объем кислорода в тех же условиях, то молекула СО2 должна быть в 1,3753 раза тяжелее молекулы кислорода (мол. масса О2 = 31,998), т.е. масса молекулы СО2 по химической шкале равна 44,008. Если из этой величины вычесть массу двух атомов кислорода, равную 31,998, мы получим атомную массу углерода - 12,01. Чтобы получить более точное значение, необходимо ввести ряд поправок, что усложняет этот метод. Тем не менее с его помощью были получены некоторые весьма ценные данные. Так, после открытия благородных газов (He, Ne, Ar, Kr, Xe) метод, основанный на измерении плотности, оказался единственно пригодным для определения их атомных масс.
Масс-спектроскопия. Вскоре после Первой мировой войны Ф.Астон создал первый масс-спектроскоп для точного определения массовых чисел различных изотопов и тем самым открыл новую эру в истории определения атомных масс. Сегодня существует два основных типа масс-спектроскопов: масс-спектрометры и масс-спектрографы (последним является, например, прибор Астона). Масс-спектрограф предназначен для изучения поведения потока электрически заряженных атомов или молекул в сильном магнитном поле. Отклонение заряженных частиц в этом поле пропорционально отношению их масс к заряду, а регистрируют их в виде линий на фотопластинке. Сравнивая положения линий, отвечающих определенным частицам, с положением линии для элемента с известной атомной массой, можно с достаточной точностью определить атомную массу нужного элемента. Хорошей иллюстрацией метода является сравнение массы молекулы СН4 (метана) с массовым числом самого легкого изотопа кислорода 16О. Одинаково заряженные ионы метана и 16О одновременно впускают в камеру масс-спектрографа и регистрируют их положение на фотопластинке. Различие в положении их линий отвечает разности масс 0,036406 (по физической шкале). Это значительно более высокая точность, чем может дать любой химический метод. Если исследуемый элемент не имеет изотопов, то определение его атомной массы не составляет особого труда. В противном случае необходимо определить не только массу каждого изотопа, но и их относительное содержание в смеси. Эту величину не удается определить с достаточной точностью, что ограничивает применение масс-спектрографического метода для нахождения атомных масс изотопических элементов, особенно тяжелых. Недавно с помощью масс-спектрометрии удалось установить с высокой точностью относительное содержание двух изотопов серебра, 107Ag и 109Ag. Измерения были выполнены в Национальном бюро стандартов США. Используя эти новые данные и более ранние измерения масс изотопов серебра, уточнили значение атомной массы природного серебра. Теперь эта величина считается равной 107,8731 (химическая шкала).
Ядерные реакции. Для определения атомных масс некоторых элементов можно использовать соотношение между массой и энергией, полученное Эйнштейном. Рассмотрим реакцию бомбардировки ядер 14N быстрыми ядрами дейтерия с образованием изотопа 15N и обычного водорода 1Н: 14N + 2H = 15N + 1H + Q В результате реакции выделяется энергия Q = 8 615 000 эВ, которая в соответствии с уравнением Эйнштейна эквивалентна 0,00948 а.е.м. Значит, масса 14N + 2H превышает массу 15N + 1H на 0,00948 а.е.м., и если мы знаем массовые числа трех любых изотопов - участников реакции, то можем найти массу четвертого. Метод позволяет определить разность массовых чисел двух изотопов с большей точностью, чем масс-спектрографический.
Рентгенография. Этим физическим методом можно определять атомные массы веществ, которые при обычной температуре образуют регулярную кристаллическую решетку. Метод основан на связи между атомной (или молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и неким коэффициентом, который определяют из расстояний между атомами в кристаллической решетке. Необходимо провести прецизионные измерения двух величин: постоянной решетки рентгенографическими методами и плотности методом пикнометрии. Применение метода ограничивается трудностями получения чистых совершенных кристаллов (без вакансий и дефектов любого рода).
Уточнение атомных масс. Все измерения атомных масс, которые были выполнены более 20 лет назад, проводились химическими методами или методом, основанным на определении плотности газов. В последнее же время данные, получаемые масс-спектрометрическими и изотопными методами, совпадают с такой высокой точностью, что Международная комиссия по атомным массам решила скорректировать атомные массы 36 элементов, причем 18 из них не имеют изотопов. См. также АВОГАДРО ЧИСЛО.
ЛИТЕРАТУРА
Кравцов В.А. Массы атомов и энергии связи. М., 1965 Воронцова Е.Р. Атомный вес. М., 1984 Эмсли Дж. Элементы (справочник). М., 1993
Энциклопедия Кольера. — Открытое общество. 2000.