- МАГНЕТОХИМИЯ
-
- раздел физ. химии, изучающий взаимосвязь между магн. и хим. свойствами веществ. Исторически первым магнетохим. подходом к изучению строения веществ считают известные правила Паскаля (P. Pascal, 1910-13), связывающие магнитную восприимчивость
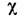 органич. соединений с суммой атомных магн. восприимчивостей и дополнит. поправками, к-рые зависят от природы химической связи и строения молекул [1]:
органич. соединений с суммой атомных магн. восприимчивостей и дополнит. поправками, к-рые зависят от природы химической связи и строения молекул [1]:
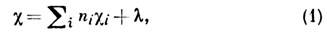
где ni - число атомов сорта i,
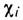 - их атомная магн. восприимчивость,
- их атомная магн. восприимчивость, 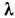 - поправка на хим. связь в молекуле. В дальнейшем Я. Г. Дорфман предложил использовать для магнетохим. исследований веществ метод, осн. на квантовомеханич. теории магн. восприимчивости Ван Флека (J. Van Vleck) [2]:
- поправка на хим. связь в молекуле. В дальнейшем Я. Г. Дорфман предложил использовать для магнетохим. исследований веществ метод, осн. на квантовомеханич. теории магн. восприимчивости Ван Флека (J. Van Vleck) [2]:
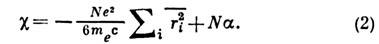
Здесь первый член описывает суммарную диамагн. восприимчивость всех атомов в молекуле (N - число молекул,
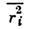 - ср. квадрат расстояния электронов от ядра), а второй член - парамагн. вклад возбуждённых состояний молекул (предполагается, что этот вклад не связан с тепловым возбуждением и не зависит от темп-ры). Существенный прогресс в понимании неразрывной связи особенностей хим. строения с характером магн. взаимодействий в твёрдых телах связан с работами Дж. Гуденафа (J. Goodenough) [3], установившего ряд качеств. закономерностей связи структурных и магн. характеристик.
- ср. квадрат расстояния электронов от ядра), а второй член - парамагн. вклад возбуждённых состояний молекул (предполагается, что этот вклад не связан с тепловым возбуждением и не зависит от темп-ры). Существенный прогресс в понимании неразрывной связи особенностей хим. строения с характером магн. взаимодействий в твёрдых телах связан с работами Дж. Гуденафа (J. Goodenough) [3], установившего ряд качеств. закономерностей связи структурных и магн. характеристик.
Совр. анализ взаимосвязи хим. и магн. свойств молекул и кристаллов основан на совместном использовании достижений теории магнетизма и расчётных квантовохим. методов.
Сильное взаимное влияние хим. связи и магн. взаимодействий обусловлено их противоположной тенденцией к коллективизации или локализации электронных состояний. Характерный пример - существование локализов. магн. моментов на ионах переходных металлов связано с наличием у ионов неспаренных электронов, к-рые в соответствии с правилами Хунда размещаются по энергетич. уровням так, что спиновой и орбитальный моменты ионов оказываются максимальными [1]. С др. стороны, хим. связывание атомов (в молекулах и твёрдых телах) состоит в образовании в большей или меньшей степени делокализов. молекулярных орбиталей, к-рые заполняются в соответствии с принципом Паули парами электронов с противоположными спинами (см. Паули принцип). Это приводит, как правило, к компенсации магн. моментов отд. атомов. Обычно энергия хим. связи существенно превышает энергию внутриатомных магн. взаимодействий. Поэтому атомы в большинстве органич. и не-органич. веществ не обладают локализов. магн. моментами, а сами вещества обнаруживают лишь диамагн. свойства, присущие системам с заполненными электронными оболочками [2]. Однако атомы переходных элементов с недостроенными d- или f -оболочками имеют большие магн. моменты, к-рые не компенсируются при вхождении их в хим. соединения, более того, нескомпенсиров. магн. моменты оказывают существенное влияние на характер хим. связи. Взаимодействия магн. моментов атомов в комплексах и соединениях переходных металлов имеют специфич. квантовую (обменную) природу (см. Обменное взаимодействие). Обменные взаимодействия носят межатомный характер, они бывают как прямыми, так и косвенными, осуществляющимися через промежуточные немагн. атомы (лиганды, см. Косвенное обменное взаимодействие), и полностью определяются типом хим. связи в соединении. Именно поэтому наблюдаются корреляции между знаком, а также величиной параметра обмена, определяющими тин магн. упорядочения, и характером хим. связи в разл. классах кристаллов и комплексных соединений [3]. Напр., кристаллы с ковалентной связью, типа NiO, являются антиферромагн. диэлектриками, тогда как металлич. тип связи благоприятствует установлению ферромагн. порядка в системе магн. моментов. Зависимость величины и знака параметра обмена в комплексах н твердофазных соединениях d -металлов от типа заполнения магн. орбиталей н геометрии связи металл-лиганд-металл устанавливают известные правила Гуденафа-Канамори [3]. Так, напр., наиб. сильной хим. связью металл - лиганд в октаэдрич. комплексах является
 -связь dz2 орбиталей металла и. р z орбиталей лиганда (рис., а).
-связь dz2 орбиталей металла и. р z орбиталей лиганда (рис., а).
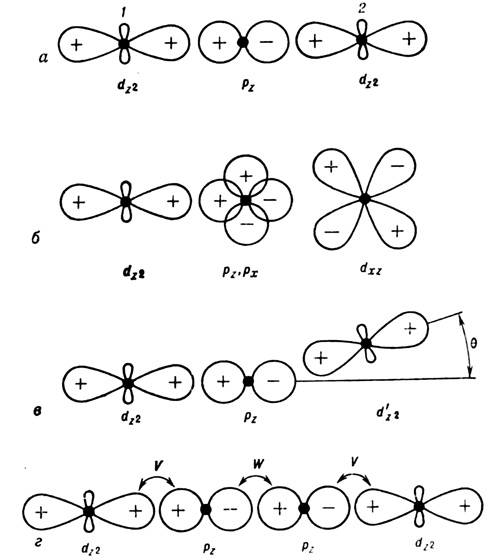
Оптимальное хим. связывание магн. электронов атома металла с заполненной оболочкой лиганда приводит в этом случае к антиферромагн. упорядочению спиновых моментов [4]. Величина осуществляющейся через лиганд косвенной обменной связи пропорциональна параметру ковалентного смешивания. Именно доминированием такого взаимодействия в NiO определяется антиферромагнетизм этого соединения.
Если магн. орбитали в комплексе имеют разную симметрию, напр. dz2 и dxz (рис., б), то хим. связывание через лиганд будет существенно слабее, одновременно очень слабой оказывается и магн. связь атомов. В сложных комплексных соединениях, а часто и в кристаллах, связи металл-лиганд-металл, как правило, неколлинеарны. Взаимодействие
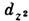 -орбиталей с s -состояниями лиганда не зависит от угла
-орбиталей с s -состояниями лиганда не зависит от угла 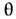 (рис., в), а взаимодействие с р z -состояниями пропорционально
(рис., в), а взаимодействие с р z -состояниями пропорционально 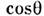 . В результате угловая зависимость обменной связи
. В результате угловая зависимость обменной связи 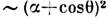 . Это простое соотношение хорошо описывает, напр., многие магн. свойства кристаллов со структурой перовскита [4]. Наконец, в комплексных соединениях d -металлов магн. атомы часто связаны друг с другом через неск. лигандов (рис., г). В случае, когда хим. связь лиганд-лиганд (W )не уступает по прочности связи металл-лиганд (V), наблюдается заметное по величине обменное взаимодействие магн. моментов. Типичный пример подобной системы - карбоксилаты меди, где магн. электроны атомов меди взаимодействуют вдоль цепочек: Сu-О-С-О-Сu [5].
. Это простое соотношение хорошо описывает, напр., многие магн. свойства кристаллов со структурой перовскита [4]. Наконец, в комплексных соединениях d -металлов магн. атомы часто связаны друг с другом через неск. лигандов (рис., г). В случае, когда хим. связь лиганд-лиганд (W )не уступает по прочности связи металл-лиганд (V), наблюдается заметное по величине обменное взаимодействие магн. моментов. Типичный пример подобной системы - карбоксилаты меди, где магн. электроны атомов меди взаимодействуют вдоль цепочек: Сu-О-С-О-Сu [5].
Совр. методы квантовохим. расчётов на ЭВМ позволяют корректно и детально описать взаимообусловленность эффектов магн. упорядочения и хим. связывания. Для этого используют т. н. спин-поляризованные подходы к анализу энергетич. спектра магнитоупорядоченных соединений, в к-рых электроны с разл. ориентацией спинов занимают разные молекулярные орбитали. В рамках таких подходов магн. взаимодействия и хим. связь рассматривают с единых общих позиций. Чаще всего для этого используют два метода расчёта: т. н. неограниченный Хартри- Фока метод и метод функционала спиновой плотности [4]. Энергии и пространств. распределения молекулярных орбиталей в рамках этих методов определяются ориентацией спинов электронов, что позволяет просто и наглядно объяснить существование нескомпенсиров. спиновой плотности на атомах переходных металлов, их магн. упорядоченность, а также степень ковалентного смешивания орбиталей магн. атомов.
Коль скоро магн. свойства соединений обусловлены особенностями их структуры и хим. связи, то, располагая эксперим. информацией о магн. характеристиках системы, удаётся решать и ряд интересных структурных и кристаллохим. задач.
Осн. эксперим. методами магн. исследований являются метод статич. магн. восприимчивости и резонансные методы - ЭПР, ЯМР, Мёссбауэра эффект и др. Зависимость магн. взаимодействий от характера хим. связи, а значит и геом. структуры молекулярных (атомных) комплексов, получают из результатов теоретич. расчётов или обобщения массивов эксперим. данных для родственных объектов. Эти данные служат основой для магнетохим. анализа строения и электронных свойств соединения. Такой путь особенно важен в тех случаях, когда неприменимы прямые рентгеноструктурные методы исследований или их возможности резко ограничены (комплексы в растворах, малые концентрации магн. центров и др.).
Популярность резонансных магн. методов связана прежде всего с их высокой чувствительностью к небольшим концентрациям парамагн. центров. Косвенные сверхтонкие взаимодействия (СТВ), выявляемые в спектрах ЭПР, позволяют определить степень переноса спиновой плотности от магн. атома к лигандам и дают возможность оценить степень ковалентности хим. связи [6, 7]. Методы ЯМР оказались эффективными при исследованиях дефектов в твёрдых телах. Так, у твёрдых растворов VCxNy ряд величин - сдвиг Найта и параметры СТВ определяются конфигурацией локального окружения атома ванадия, поэтому ЯМР-исследования на ядрах 51V дают детальную информацию о характере ближнего порядка и его нарушениях в карбонитридах.
Измерения магн. восприимчивости наиб. часто используют при изучении типа хим. связи и особенностей строения парамагн. комплексов [5] и диамагн. молекул [2]. Диамагн. восприимчивость органич. соединений с замкнутой электронной оболочкой содержит две составляющие: суммарную ланжевеновскую диамагн. восприимчивость отд. атомов и температурно независимую парамагн. восприимчивость [см. (2)], связанную с несферич. деформацией электронных оболочек при образовании хим. связи (см. Ванфлековский парамагнетизм). Сравнение значения диамагн. восприимчивости соединения с независимо определённой аддитивной суммой восприимчивостей отд. атомов позволяет установить характер хим. связи. Так, наличие в молекуле двойной связи заметно снижает диамагн. восприимчивость, тогда как ароматич. связь с коллективизацией электронов приводит к росту восприимчивости и появлению магн. анизотропии. Измерения восприимчивости позволяют исследовать сложные процессы, напр, полимеризацию, поскольку добавление каждого мономера изменяет диамагн. восприимчивость полимера на известную величину, определять относительное содержание неск. таутомеров или различия между неск. структурами сложных ароматич. веществ [2]. Несомненным достоинством метода магн. восприимчивости и др. подобных методов является слабое воздействие внеш. магн. поля на хим. реакции и равновесные состояния, тогда как обычные хим. методы анализа, связанные с добавлением индикатора-реагента, нарушают хим. равновесие.
В случае парамагн. комплексов или соединений d- металлов измерения температурной зависимости магн. восприимчивости позволяют определить величины атомных магн. моментов и параметры обменного взаимодействия. Изучение парамагн. восприимчивости многоядерных кластеров со сложной структурой [5]позволяет исследовать особенности их энергетич. спектра и строения.
Интересной областью М. является исследование влияния спиновых состояний разл. атомов и их обменных взаимодействий на характер хим. реакций между парамагн. частицами в растворах [8), в т. ч. в многокомпонентных и полимерных растворах, а также в биологич. системах.
Заметно возросла роль магнетохим. исследований каталитич. активности металлов и сплавов. Для этих объектов измерение магн. восприимчивости является одним из наиболее точных аналитич. методов определения содержания ничтожных добавок активных веществ, напр. ферромагн. частиц Ni или МnО 2, а также их взаимодействия, поскольку хим. связывание резко меняет магн. свойства объектов. Данные о магн. восприимчивости дают возможность также определять зависимость каталитич. активности металла от размера его частиц. Такого рода исследования позволили сделать важные выводы о составе и структуре многих катализаторов, а также получить данные об электронных взаимодействиях между адсорбентом и адсорбированным веществом, к-рые вряд ли могли быть получены к.-л. др. методами [5].
Лит.:1) Вонсовский С. В., Магнетизм, М., 1971; 2) Дорфман Я. Г., Диамагнетизм и химическая связь, М., 1961; 3) Гуденаф Д., Магнетизм и химическая связь, пер. с англ., М., 1968; 4) Губанов В. А., Лихтенштейн А. И., Постников А. В., Магнетизм и химическая связь в кристаллах, М., 1985; 5) Калинников В. Т., Ракитин Ю. В., Введение в магнетохимию, М., 1980; 6) Цукерблат Б. С., Белинский М. И., Магнетохимия и радиоспектроскопия обменных кластеров, Киш., 1983; 7) Плетнев Р. Н., Сидоров А. А., Зенцов В. П., Губанов В. А., ЯМР и сверхтонкие взаимодействия в твердых телах, Свердловск, 1986; 8) Замараев К. И., Молин Ю. Н., Салихов К. М., Спиновый обмен, Новосиб., 1977. В. Л. Губанов, А. И. Лихтенштейн.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.