- РАСТВОРЫ
-
- системы, состоящие из молекул, атомов и(или) ионов неск. разл. типов, при этом числа разл. частиц не находятся в к.-л. определённых стехиометрич. соотношениях друг с другом (что отделяет Р. от хим. соединений). К Р. обычно относят такие многокомпонентные системы, в к-рых при неизменных внеш. условиях достигается состояние термодинамич. равновесия.
Агрегатное состояние Р. может быть твёрдым ( твёрдые растворы), жидкокристаллическим ( жидкие кристаллы), жидким или газообразным. Будучи макроскопически пространственно однородными, на молекулярных масштабах Р. могут обладать своеобразной микроструктурой (микрогетерогенные растворы, или ассоциирующие коллоиды), к-рая определяется темп-рой, давлением и составом Р. Если микроструктура Р. является регулярной (в одном, двух или трёх измерениях), то его относят к лиотропным жидким кристаллам. Жидкие Р. с нерегулярной микроструктурой (обычно многокомпонентные, содержащие органич. вещества и соли) наз. эмульсиями (микроэмульсиями). Суспензии частиц размером от неск. нм до тысяч нм относят к коллоидным Р.
В том случае, когда молекулы растворённого вещества диссоциируют на ионы, Р. относят к особому классу - Р. электролитов. Отличит. свойствами обладают Р. полимеров.
Термодинамические свойства растворов
Термодинамич. свойства Р. описываются общими для многокомпонентных систем соотношениями термодинамики. Число веществ n, кол-ва к-рых в состоянии полного термодинамич. равновесия могут быть заданы произвольно, наз. числом независимых компонент Р. Если число молекул (атомов) одной из компонент системы N намного превышает числа N1, ..., Nn-1 молекул остальных компонент, Р. наз. разбавленным (слабым). Вещество, содержащее N частиц, в этом случае наз. растворителем, остальные компоненты - растворёнными веществами. Величины
ci = Ni/N. (здесь
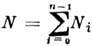 ) наз. молярными (молекулярными) концентрациями (используются также весовые и объёмные концентрации). Согласно Гиббса правилу фаз, в системе, состоящей из n компонент, в равновесии не может находиться более n + 2 фаз. Состояние Р. описывается n + 1 переменной (n -1 значение концентраций, темп-pa Т и давление р )и может быть изображено точкой в n + 1-мерном пространстве. Если в этом пространстве построить гиперповерхности меньшего числа измерений, на к-рых выполняются условия равновесия двух или большего числа фаз, то получится поверхность, характеризующая состояние системы,- т. н. фазовая диаграмма системы (или диаграмма состояния). Обычно пользуются сечениями фазовой диаграммы различными плоскостями.
) наз. молярными (молекулярными) концентрациями (используются также весовые и объёмные концентрации). Согласно Гиббса правилу фаз, в системе, состоящей из n компонент, в равновесии не может находиться более n + 2 фаз. Состояние Р. описывается n + 1 переменной (n -1 значение концентраций, темп-pa Т и давление р )и может быть изображено точкой в n + 1-мерном пространстве. Если в этом пространстве построить гиперповерхности меньшего числа измерений, на к-рых выполняются условия равновесия двух или большего числа фаз, то получится поверхность, характеризующая состояние системы,- т. н. фазовая диаграмма системы (или диаграмма состояния). Обычно пользуются сечениями фазовой диаграммы различными плоскостями.Диаграммы плавления и кипения растворов. В отличие от чистых веществ, изменение агрегатного состояния Р. происходит в нек-ром интервале изменения концентраций компонент, темп-ры и(или) давления. Простейший случай равновесия двух фаз реализуется, когда обе компоненты, образующие Р., в обеих фазах смешиваются в произвольных отношениях. Кривые равновесия в этом случае не имеют максимумов и минимумов и образуют характерную "сигару" (диаграмма Т- с, с - концентрация; рис. 1). Пусть для определённости рассматриваемые фазы представляют собой жидкость (низкотемпературная фаза II) и пар (высокотемпературная фаза I). Если изображающая точка системы ( Т, с )лежит выше кривой FAG, то агрегатное состояние системы - пар, если ниже кривой FCG- жидкость. Заштрихованная область между кривыми FAG и FCG соответствует равновесию двух фаз (представляющих собой т. н. насыщенные растворы),
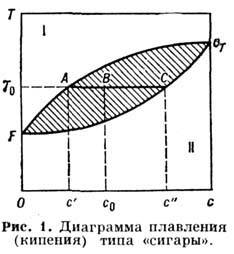
концентрации к-рых характеризуются растворимостью веществ и равны с' и с ", в точке В массы определяются "правилом рычага", согласно к-рому кол-ва молекул в фазах I и II обратно пропорциональны длине отрезков соответственно АВ и ВС:
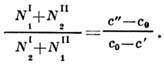
В случае равновесия системы жидкость - пар кривая FAG наз. кривой конденсации,a FCG- кривой кипения. В случае равновесия твёрдой и жидкой фаз кривая FAG наз. кривой ликвидуса, a FCG- кривой солидуса.
Фазовые диаграммы типа "сигары" дают Р. веществ, близких по хим. свойствам: для диаграмм плавления- это, напр., бинарные (двухкомпонентные) растворы Ge - Si, Ag - Аи, Си - Ni, AgCl - NaCl, для диаграмм кипения - системы бензол - толуол, этиловый спирт - вода и др. При относительно небольшом хим. отличии смешиваемых веществ А а В кривые кипения и конденсации могут иметь максимум или минимум, в к-ром эти кривые касаются друг друга (рис. 2). Р., состав к-рого соответствует точке касания (точка А), наз. азеотропным. Фазовый переход (кипение или плавление) в Р. такого состава происходит так же, как в чистом веществе,- целиком. Когда точка касания является максимумом кривых равновесия (рис. 2, о), кипение Р. произвольного нач. состава приводит к смещению изображающей точки системы в положение А. Т. о., азеотропная точка является устойчивой предельной точкой процесса кипения. Если же касание кривых равновесия происходит в их минимуме (рис. 2, б), то в процессе фазового перехода при повышении темп-ры изображающая точка системы сдвигается к одному из чистых веществ; азеотропная точка достигается при охлаждении смеси.
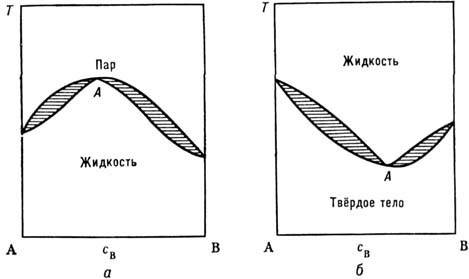
Рис. 2. Примеры диаграмм состояния: а - теплота смешения в жидкости меньше, чем в паре; б - теплота смешения в твёрдой фазе больше, чем в жидкой.
При повышении p в системе жидкость - пар форма "сигары" изменяется, а при давлениях выше критического (см. Критическая точка )для одной из компонент, когда отсутствует различие между двумя фазами этого вещества, "сигара" вырождается в петлю путём смыкания кривых кипения и конденсации в нек-рой (критической) точке (рис. 3).
Рис. 3. Пример диаграммы состояния двухкомпонентной системы жидкость - дар в случае, когда давление в системе превышает критическое давление компоненты А. Разделение смеси на жидкую и газообразную фазы имеет смысл лишь в пределах заштрихованной области. К- критическая точка.
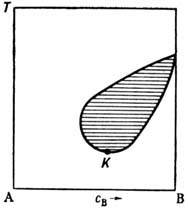
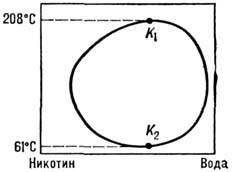
Диаграммы смешения растворов. Наряду с равновесиями фаз, находящихся в различных агрегатных состояниях, в Р. могут сосуществовать фазы, находящиеся в одном агрегатном состоянии, напр. жидком. На рис. 4 изображена диаграмма, соответствующая случаю ограниченной смешиваемости двух веществ в одной жидкой фазе. Жидкости полностью смешиваются в области, лежащей над кривой AKB, и ограниченно смешиваются в области, лежащей под этой кривой (где имеет место расслоение Р. на две жидкие фазы с составом, определяемым "правилом рычага"). Точка К максимума кривой - критическая: в окрестности этой точки наблюдаются аномалия теплоёмкости, критич. опалесценция и др. критические явления. Существуют жидкие системы (напр., триэтиламин - вода), для к-рых область неограниченной смешиваемости лежит ниже нек-рой кривой и к-рые имеют нижнюю темп-ру смешения, а также системы, имеющие как верхнюю, так и нижнюю темп-ры смешения (рис. 5).
Рис. 4. Диаграмма смешения системы фенол - вода. К- критическая точка смешения с параметрами Т к =66 С, с к = 0,65.
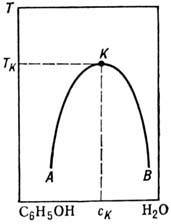
Верхняя критич. темп-pa смешения растёт с увеличением различий хим. свойств смешиваемых веществ.
Рис. 5. Диаграмма смешения системы никотин - вода. Жидкости полностью смешиваются вне области, ограниченной замкнутой кривой.
Качественно эта зависимость выражается в понятии миксотропного ряда, в к-ром все вещества располагаются в соответствии со значением приписываемого каждому из них т. н. эффективного заряда е (табл.; численные значения е получены не для всех веществ, но они расположены в порядке убывания е). Верхняя темп-pa смешения растёт с увеличением разности "зарядов" смешиваемых веществ.
Миксотропный ряд
Вещество
Химическая формула
Эффективный заряд е, в относит. ед.
Вода
Н 2 О
48
Молочная кислота
CH3CHOHCOOH
Формамид
NH2CHO
Муравьиная кислота
HCOOH
Уксусная кислота
СН 3 СООН
Метанол
СН 3 ОН
29
Этанол
CH3CH2OH
26
Анилин
C6H5OH
24
Ацетон
СН 3 СОСН 3
20
Диоксан
(СН 2 ОСН 2)2
20
Пиридин
C5H5NH
Эфир этиловый
С 6 Н 5 ОС 6 Н 5
Хлороформ
CHCL3
Дихлорэтан
(СН 2 С1)2
20
Бензол
C6H6
19
Толуол
С 6 Н 5 СН 3
18
Четырёххлористый
углерод
CCl4
Циклопентан
C5H10
Гептан
CH3(CH2)5CH3
Октан
GH3(CH2)6CH3
15
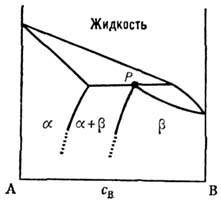
Если верхняя критич. темп-pa смешения веществ в низкотемпературной фазе оказывается выше темп-ры минимума кривых равновесия, изображённых на рис. 2 (б), то фазовая диаграмма системы приобретает вид, аналогичный изображённому на рис. 6. Такая диаграмма принадлежит к эвтектическому типу; Р., имеющий состав, отвечающий точке эвтектики Е, наз. эвтектикой. Плавление эвтектики происходит при определ. темп-ре, как и плавление химически чистого вещества. В Р. с ограниченной взаимной растворимостью могут возникать также фазовые диаграммы перитектического типа (рис. 7). Пери-тектическая точка имеет самую высокую темп-ру плавления определённой твёрдой фазы, в то время как точка эвтектики - наинизшую темп-ру затвердевания определённой жидкой фазы. Эвтектическая и перитектическая точки - это точки сосуществования трёх фаз: жидкой и двух твёрдых.
Рис. 6. Фазовая диаграмма системы Sn - Pb эвтектического типа, a, b - твёрдые растворы. Точка пересечения трёх линий, в которых сосуществуют жидкая и две твёрдые фазы,- точка эвтектики.
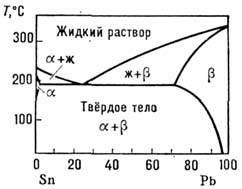
Рис. 7. Фазовая диаграмма перитектического типа. P- перитектическая точка, a,b- твёрдые растворы.
Законы слабых растворов. Термодинамический потенциал слабого Р. имеет вид
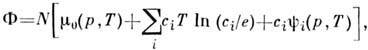
где m0(p, T)- химический потенциал чистого растворителя, yi(p, T) - нек-рая ф-ция, зависящая от природы растворителя. Растворённое вещество распределяется между разл. фазами т. о., что отношение концентрации cI и сII в этих фазах зависит лишь от р, Т, но не от полного кол-ва растворённого вещества (т. н. закон распределения):
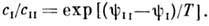
В частности, когда одна из фаз представляет собой газ, имеет место Генри закон, согласно к-рому концентрация слабого Р. пропорциональна давлению газа р. При растворении в жидкости нелетучего вещества давление p насыщенного пара над Р. меньше, чем давление над чистым растворителем p0:

(Рауля закон), где
 и
и 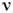 - числа молей растворённого вещества и растворителя в единице объёма Р. По отношению к нелетучему веществу поверхность жидкости ведёт себя как непроницаемая перегородка, и (1) представляет собой частный случай выражения для осмотического давления (см. Осмос )слабых Р. При этом между частями системы, разделёнными перегородкой, проницаемой для растворителя, но непроницаемой для растворённых веществ, возникает разность давлений
- числа молей растворённого вещества и растворителя в единице объёма Р. По отношению к нелетучему веществу поверхность жидкости ведёт себя как непроницаемая перегородка, и (1) представляет собой частный случай выражения для осмотического давления (см. Осмос )слабых Р. При этом между частями системы, разделёнными перегородкой, проницаемой для растворителя, но непроницаемой для растворённых веществ, возникает разность давлений 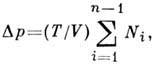
где V- объём части сосуда, занятой растворёнными веществами.
Из закона Рауля (1) следует, что при пост. давлении темп-pa кипения Р.
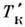 выше темп-ры кипения чистого растворителя
выше темп-ры кипения чистого растворителя 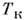 :
: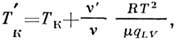
где m - молекулярная масса веществ растворителя, qLV- уд. теплота испарения. Темп-pa замерзания Р.
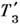 ниже темп-ры замерзания Т З чистого растворителя:
ниже темп-ры замерзания Т З чистого растворителя: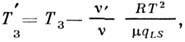
где qLS- уд. теплота плавления.
Ассоциирующие растворы
Мицеллообразование. Физ.-хим. свойства Р. широкого класса веществ, молекулы к-рых имеют асиммет-рич. форму,- т. н. амфифильные вещества (наз. также дифильными или поверхностно-активными веществами), определяются образованием в них т. н. мицелл - агрегатов молекул растворённого вещества. Такие Р. паз. мицеллярными.
Амфифильные вещества имеют вытянутые молекулы (часто линейные) длиной 20-30
 , имеющие хорошо выраженные гидрофильные пли олеофильные (жирные, гидрофобные) части (см. Гидрофильность и гидрофоб-ность )К таким веществам относятся соли жирных к-т (напр., мыло -стеарат натрия), имеющие в составе молекулы гибкую парафиновую цепь С n Н 2n+1 ("жирный хвост"), присоединённую к полярной группе - "головке" "Головка" образована группой атомов, соединенных полярными связями. Амфифильными молекулами являются также липиды и фосфолипиды, входящие в состав клеточных мембран ( си. Клеточные структуры).
, имеющие хорошо выраженные гидрофильные пли олеофильные (жирные, гидрофобные) части (см. Гидрофильность и гидрофоб-ность )К таким веществам относятся соли жирных к-т (напр., мыло -стеарат натрия), имеющие в составе молекулы гибкую парафиновую цепь С n Н 2n+1 ("жирный хвост"), присоединённую к полярной группе - "головке" "Головка" образована группой атомов, соединенных полярными связями. Амфифильными молекулами являются также липиды и фосфолипиды, входящие в состав клеточных мембран ( си. Клеточные структуры).Участок диаграммы состояния Р. амфифильного вещества приведён на рис. 8. Кривая равновесия АВС отделяет области жидких фаз I (молекулярный Р.) и II (мицеллярный Р., или ассоциирующий коллоид, см. ниже) от твёрдой фазы III. Области молекулярного и мицеллярного Р. разделены нек-рой переходной областью BD, а не линией, как в обычном случае равновесия двух фаз. Мин. темп-pa , при к-рой возможно образование мицелл, наз.
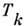 температурой Крафта. Концентрация амфифильного вещества с*, при к-рой начинается образование мицелл, наз. критической концентрацией мицел-лообразования (ККМ). ККМ сильно зависит от темп-ры, ионной силы Р. (сумма значений концентраций всех ионов Р., умноженных на квадрат их зарядов) и т. д. ККМ падает с ростом длины "жирного хвоста" молекулы приближённо линейно при числе атомов углеводородной цепи n <10-15; при больших и возможно отклонение от линейного закона. Характер изменения нек-рых физ. свойств Р. при мицеллообра-зовании представлен на рис. 9.
температурой Крафта. Концентрация амфифильного вещества с*, при к-рой начинается образование мицелл, наз. критической концентрацией мицел-лообразования (ККМ). ККМ сильно зависит от темп-ры, ионной силы Р. (сумма значений концентраций всех ионов Р., умноженных на квадрат их зарядов) и т. д. ККМ падает с ростом длины "жирного хвоста" молекулы приближённо линейно при числе атомов углеводородной цепи n <10-15; при больших и возможно отклонение от линейного закона. Характер изменения нек-рых физ. свойств Р. при мицеллообра-зовании представлен на рис. 9. Рис. 8. Диаграмма состояния раствора амфифильного вещества вблизи точки мицел-лообразования. Т к - температура Крафта; I - молекулярный раствор; II -мицеллярный раствор; III - кристалл.
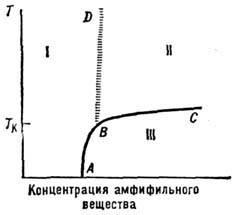
Рис. 9. Изменение осмотического давления раствора ( р'), коэффициентов вязкости (h), электропроводности (s) и поверхностного натяжения (a) вблизи критической концентрации мицеллообра-зования с*; для раствора додецилсульфата натрия (C12H25OSO3Na) в воде с* = =8·10-3 см -3
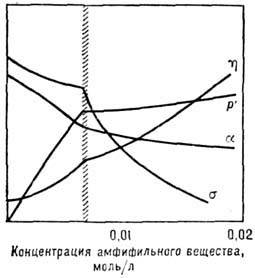
Форма и структура мицелл зависят от типа растворителя (полярный или гидрофобный), от концентрации P его состава, темп-ры и др. Вблизи ККМ форма мицелл близка к сферической. В полярной среде (напр., в воде) мицеллы имеют углеводородное ядро, а полярные "головки" обращены к молекулам воды. В жирной среде мицелла имеет обращённую структуру: полярные "головки" образуют ядро, а олеофильные "хвосты" контактируют с растворителем (рис. 10). Каждая мицелла в Р. содержит 20-100 молекул амфифильного вещества (т. н. число агрегации). Обычно часть полярных "головок" молекул диссоциирована на ионы (для ионногенных амфифильных веществ).
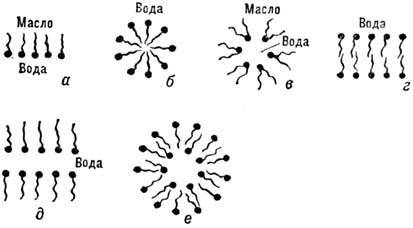
Рис 10. Структура агрегатов в растворах амфифильного веще-ства· а- гибсовский монослой на поверхности раздела жирной и полярной сред; б - сферическая мицелла в полярном растворителе; в - обращённая сферическая мицелла в жирной среде; г - ламелла (бислой) в полярной среде; д - обращенная ла-мелла (мыльная плёнка); е - пузырёк (везикула), образованный в полярной среде.
С ростом концентрации Р. форма мицелл может изменяться: они принимают цилиндрическую, дискообразную форму или форму трёхосного эллипсоида. Это проявляется в изменении индикатрисы рассеяния света Р. и в изменении зависимости вязкости Р. от концентрации. В нек-рых случаях в Р. могут присутствовать ци-линдрич. мицеллы, содержащие ~103-104 молекул. В области концентраций Р., превышающих ККМ, именно мицеллы являются элементарными структурными единицами, определяющими физ. свойства возникающих в Р. фаз, как изотропных, так и жидкокристаллических (см. ниже).
Надмолекулярные жидкокристаллические структуры в растворах. Подобно молекулярным, мицеллярные Р. при нек-рой концентрации мицелл могут расслаиваться. Вблизи критич. точек расслоения (к-рые могут быть как верхними, так и нижними) наблюдаются критич. явления. Отслаивающаяся при увеличении концентрации более плотная фаза может быть как изотропной, так и анизотропной (см. Жидкие кристаллы). В бинарных системах обычно возникают гексагональная, ламеллярная (смектическая) и (или) кубическая фазы. Переход между ними происходит вследствие изменения формы или (и) размеров мицелл.
Гексагональные фазы образованы цилиндрич. мицеллами неопределённой длины, упакованными в двумерную решётку, имеющую гексагональную симметрию (рис. 11). Структура мицелл может быть нормальной или обращённой в зависимости от типа амфифильного вещества и растворителя. Радиус нормальных цилиндрич. мицелл примерно на 10- 30% меньше длины
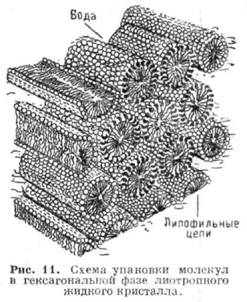
полностью вытянутой амфифильной молекулы, расстояние между цилиндрами в зависимости от содержания воды изменяется в пределах 8-50
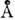 . Для обращённых мицелл диаметр водного цилиндра составляет 10-20
. Для обращённых мицелл диаметр водного цилиндра составляет 10-20 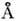 , расстояние между ними ок. полутора длин "жирных хвостов" амфифильных молекул.
, расстояние между ними ок. полутора длин "жирных хвостов" амфифильных молекул.Ламеллярные (смектические)фазы образованы дискообразными мицеллами неопределённого диаметра (ламсллами). Толщина ламеллы на 10- 30% меньше удвоенной длины амфифильной молекулы (ряс. 12), величина водного промежутка между ламеллами изменяется при их набухании. Если данное вещество образует в Р. гексагональные фазы с мицеллами как нормального, так и обращённого типов, то ламеллярная фаза располагается на фазовой диаграмме в области концентраций, промежуточных между двумя гексагональными фазами.
В зависимости от темп-ры и состава Р. амфи-фильные молекулы в ла-медлах могут находиться в "расплавленном" или "кристаллическом" состоянии. Фаза ламеллярного типа, возникающая при затвердевании парафиновых цепей молекул при понижении темп-ры, носит название фазы геля. Толщина ламеллы в этих фазах может составлять одну или две длины полностью вытянутой амфифильной молекулы. Молекулы упакованы в двумерную гексагональную решётку; площадь, приходящаяся на одну молекулу в бислое, близка к минимально возможной (при одной парафиновой цепи в "жирном хвосте" - ок. 20
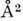 ). Длинные оси молекул могут быть наклонены по отношению к нормали амфифильного слоя. Водный промежуток составляет обычно 10-20
). Длинные оси молекул могут быть наклонены по отношению к нормали амфифильного слоя. Водный промежуток составляет обычно 10-20 , но может возрастать до "200
, но может возрастать до "200 (т. н. неограниченное набухание), если в системе присутствуют ионогенные амфифильные молекулы, подобные молекулам жирных кислот. Т. о., согласно классификации, принятой для термотропных жидких кристаллов, гели соответствуют смектич. фазам типов В A и BC.
(т. н. неограниченное набухание), если в системе присутствуют ионогенные амфифильные молекулы, подобные молекулам жирных кислот. Т. о., согласно классификации, принятой для термотропных жидких кристаллов, гели соответствуют смектич. фазам типов В A и BC.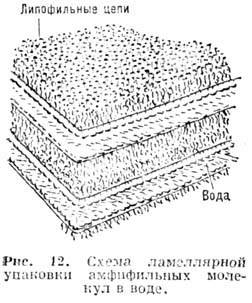
При добавлении в систему воды ламеллярные фазы втягивают воду - набухают. При этом возможны два типа набухания. В первом случае весь добавленный растворитель проникает в пространство между поляр-выми "головками" амфифильных молекул, что приводит к увеличению уд. площади, приходящейся на одну молекулу в ламелле. Период ламеллярной структуры остаётся примерно постоянным. Во втором случае при набухании происходит увеличение периода структуры, пропорциональное кол-ву добавленной воды, при пост. уд. площади на молекулу. Возможны также промежуточные типы набухания лиотропных смектич. фаз. Тип набухания не зависит от длины "жирного хвоста" молекулы в гомологич. ряду данного вещества, а определяется гл. обр. видом её полярной "головки" и "обменным" катионом (ионом щелочного металла, входящим в её состав). Напр., уд. площадь, приходящаяся на полярную "головку" молекулы мыла, при прочих равных условиях возрастает в ряду "обменных" катионов Na+, К +, Rb+, Cs+.
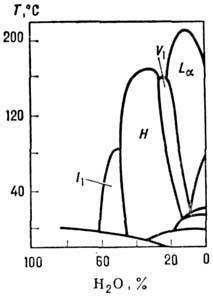
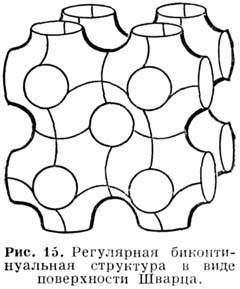
Кубические фазы могут возникать при концентрациях Р., промежуточных между концентрациями гексагональной фазы и изотропного мицеллярного Р. либо между концентрациями ламеллярной и гексагональной фаз (рис. 13). Кубич. фазы, обладающие трёхмерной периодичностью, по существу являются не жидкокристаллическими, а относятся к т. н. пластич. кристаллам. Вследствие больших коэф. вязкости (h ! 102 пуаз) н изотропии оптич. и магн. свойств ку-бич. фазы наз. также вязкими изотропными фазам и. Для фаз, расположенных между гексагональной фазой и мицеллярным Р., наиб. вероятна структура с кубич. плотной упаковкой сферич. мицелл (рис. 14), а для фаз, расположенных в области концентраций между гексагональной и ламеллярной фазами, предложены т. н. биконтинуальные структуры, для к-рых поверхность, образованная полярными "головками" амфифильных молекул, делит трёхмерное пространство на две взаимопроникающие области - полярную и гидрофобную. На рис. 15 изображена одна из возможных структур такого типа, поверхность полярных групп для к-рой представляет собой т. н. поверхность Шварца - поверхность, имеющую пост. отрицат. кривизну в каждой точке. Как правило, в бинарных системах определённое амфифильное вещество образует лишь нек-рые из перечисленных фаз. В многокомпонентных системах, содержащих кроме амфифильных и др. компоненты, возможно существование не только перечисленных, но и др. фаз (напр., нематических).
Рис. 13. Фазовая диаграмма растпора хлорида додециламмо-нпя и воде. I1- кубическая фаза, образованная сферическими мицеллами; Н - гексагональная фаза; La - ламеллярная фаза; V1 - вязкая изотропная кубическая фаза.

Нематические фазы. Нематич. структуры (ориентацией-но упорядочен-ные; см. Дальний и ближний порядок )могут быть образованы мицеллами разл. типов: цилиндрическими, дискообразными или имеющими вид трёхосного эллипсоида. В зависимости от типа мицелл различают три типа нематич. структур, два из к-рых являются одноосными, а третий - двухосным. При изменении состава или (и) темп-ры Р. возможны переходы одного типа нематич. упорядочения в другие.
Тензоры диэлектрич. проницаемости eik и диамагн. восприимчивости
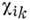 для одноосных нематиков имеют два разл. собств. значения
для одноосных нематиков имеют два разл. собств. значения 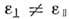 и
и 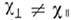 (соответственно показатели преломления обыкновенной и необыкновенной эл.-магн. волн также различаются, см. Анизотропия). Во внеш. магн. поле ось нематиков, образованных цилиндрич. мицеллами, ориентируется параллельно полю, т. е. они имеют положит. анизотропию диамагн. проницаемости:
(соответственно показатели преломления обыкновенной и необыкновенной эл.-магн. волн также различаются, см. Анизотропия). Во внеш. магн. поле ось нематиков, образованных цилиндрич. мицеллами, ориентируется параллельно полю, т. е. они имеют положит. анизотропию диамагн. проницаемости: Анизотропия показателя преломления для этих фаз отрицательна:
Анизотропия показателя преломления для этих фаз отрицательна:  Напротив, выделенная ось нематиков, образованных дисками, ориентируется перпендикулярно магн. полю; в этом случае c3 < 0, na > 0. Знак диамагн. анизотропии определяется анизотропией магн. свойств углеводородных ядер мицелл: разностью восприимчивостей "жирных хвостов" вдоль и поперёк осп амфифильной молекулы и степенью упорядочения этих молекул относительно оси мицеллы. В частности, для веществ, молекулы к-рых содержат в составе "жирного хвоста" одно или неск. ароматич. колец, знак анизотропии магн. восприимчивости может быть противоположным указанному выше. Знак диэлектрич. проницаемости нематиков определяется величиной деполяризующего действия мицелл, находящихся в водной среде. По абс. величине значения анизотропии показателя преломления и диамагн. анизотропии, как правило, на 1-2 порядка меньше, чем вслучае термотропных нематиков, и составляют
Напротив, выделенная ось нематиков, образованных дисками, ориентируется перпендикулярно магн. полю; в этом случае c3 < 0, na > 0. Знак диамагн. анизотропии определяется анизотропией магн. свойств углеводородных ядер мицелл: разностью восприимчивостей "жирных хвостов" вдоль и поперёк осп амфифильной молекулы и степенью упорядочения этих молекул относительно оси мицеллы. В частности, для веществ, молекулы к-рых содержат в составе "жирного хвоста" одно или неск. ароматич. колец, знак анизотропии магн. восприимчивости может быть противоположным указанному выше. Знак диэлектрич. проницаемости нематиков определяется величиной деполяризующего действия мицелл, находящихся в водной среде. По абс. величине значения анизотропии показателя преломления и диамагн. анизотропии, как правило, на 1-2 порядка меньше, чем вслучае термотропных нематиков, и составляют 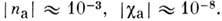
При изменении направления внеш. магн. поля нема-тич. структуры переориентируются. Время соответствующего переходного процесса в магн. поле напряжённостью H~104 Э варьируется в пределах 1-104 с в зависимости от содержания воды в образце. Модули упругости лиотропных нематич. кристаллов на 1-2 порядка меньше, чем в случае термотропных жидких кристаллов: К= 10-7-10-9 дн/см 2. Их величина определяется энергией взаимодействия между мицеллами в Р., к-рая складывается из энергии ван-дер-ваальсовых межатомных взаимодействий и электростатич. энергии взаимодействия ионов, находящихся в Р. и на поверхности мицелл. В нематич. фазах расстояние между мицеллами (цилиндрами и дисками) составляет обычно неск. сотен А, и искажение структуры растворителя, вызванное присутствием мицелл, по-видимому, слабо сказывается на взаимодействии агрегатов. В нематич. структурах с длиной цилиндрич. мицелл ~103
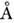 p более существенное значение имеет изгиб мицелл, энергия к-рого сравнима с энергией взаимодействия между мицеллами.
p более существенное значение имеет изгиб мицелл, энергия к-рого сравнима с энергией взаимодействия между мицеллами.Дефекты и текстуры лиотропных жидких кристаллов. Ближний порядок, существующий в упаковке молекул в мицеллы, а также во взаимном расположении мицелл в Р., определяет особенности текстуры макроскопич. образца. Так, для нематич. лиотропных фаз осн. дефектами упаковки мицелл, к-рые определяют характерную картину изображения образца, получаемую с помощью оптич. поляризац. микроскопа, являются дисклинации. Структура дисклинации в лиотропных нематич. кристаллах такая же, как в термотропных.
В ламеллярных фазах наим. энергию имеют деформации структур, при к-рых величина водного промежутка постоянна и равна своему равновесному значению во всём объёме образца, за исключением особых линий. Этому условию удовлетворяют краевые дислокации и различные конфокальные домены, простейшими из к-рых являются миелиновые фигуры (многослойные структуры, представляющие собой слои, свёрнутые по спирали; рис. 16). Краевые дислокации, к-рых в лиотропных смектич. жидких кристаллах может быть, по крайней мере, два типа (рис. 17), приводят к образованию т. н. террас Гранжа-на, видимых в оптический и электронный микроскопы, а также к образованию разл. пучков и сеток.
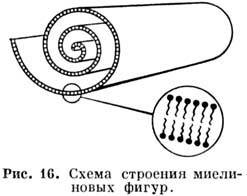
Структура дефектов в ламеллярных фазах существенно зависит от содержания воды в образце н от темп-ры. Одноврем. с изменением текстуры происходит изменение электропроводности Р. и коэф. диффузии ионов. При охлаждении системы в момент образования геля вследствие наклона амфифильных молекул в биослоях может возникать волнообразная деформация ламелл (наблюдаемая в электронный микроскоп и проявляющаяся в особенностях рассеяния рентг. лучей).
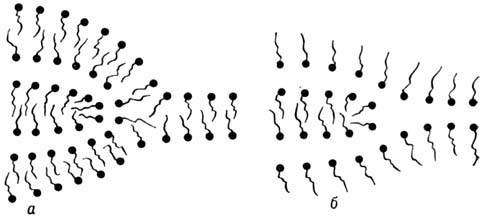
Рис. 17. Два типа краевых дислокаций в лиотропных смектических структурах.
Микроэмульсии
Добавление в систему несмешиваемых в обычных условиях жидкостей (напр., систему масло - вода) амфи-фильного вещества [а в нек-рых случаях - спирта и (или) неорганич. соли] качественно изменяет свойства системы. Растворимость масла в воде резко возрас-тает при концентрации амфифильного вещества, превышающей ККМ. Молекулы гидрофобного вещества располагаются в углеводородных ядрах мицелл, размеры к-рых при этом увеличиваются - мицеллы набухают. Такое увеличение растворимости гидрофобных веществ в полярных растворителях (или полярных веществ в жирном растворителе) с образованием агрегатов наз. солюбилизацией. Радиус набухших мицелл в нек-рых случаях может достигать неск. сотен
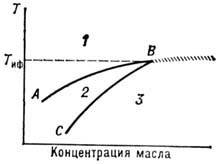
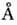 ; мицеллярные Р. при этом наз. микроэмуль-сиями типа "масло в воде" (o/w). Способность мицелл набухать в масле обычно ограничена, и при достижении нек-рой критич. концентрации масло отслаивается в виде отд. фазы. На рис. 18 изображён участок фазовой диаграммы солюбилизированного масла; равновесию фазы масла и солюбилизированного в воде масла отвечает кривая солюбилизации ВС.
; мицеллярные Р. при этом наз. микроэмуль-сиями типа "масло в воде" (o/w). Способность мицелл набухать в масле обычно ограничена, и при достижении нек-рой критич. концентрации масло отслаивается в виде отд. фазы. На рис. 18 изображён участок фазовой диаграммы солюбилизированного масла; равновесию фазы масла и солюбилизированного в воде масла отвечает кривая солюбилизации ВС.Рис. 18. Схематическое изображение фазовой диаграммы масла, солюбилизированного в воде: 1- трёхфазная область (вода + масло + амфифил); S- однородная прозрачная фаза (масло, солюбилизированное в воде); 3- двухфазная система (солюбилизированное в воде масло + масло). АВ- кривая помутнения раствора; ВС- кривая солюбилизации; T иф - температура инверсии фаз.
Радиус набухших мицелл определяется площадями, приходящимися на полярную "головку" на поверхностях раздела вода - амфифил (
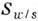 ) и масло - амфифил (
) и масло - амфифил (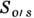 ). Для неионных амфифильных молекул, размеры полярной и гидрофобной частей к-рых примерно равны, предельное значение радиуса кривизны R поверхности масло - вода определяется соотношением
). Для неионных амфифильных молекул, размеры полярной и гидрофобной частей к-рых примерно равны, предельное значение радиуса кривизны R поверхности масло - вода определяется соотношением 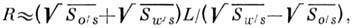
где L- полная длина амфифильной молекулы. Величина, стоящая в знаменателе этого выражения, зависит от темп-ры и состава Р., и при нек-рых значениях этих параметров (при темп-ре инверсии фаз) кривизна поверхности мицеллы может менять знак, т. е. происходит обращение микроэмульсии:
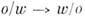 ("масло в воде" : "вода в масле"). Вблизи темп-ры инверсии фаз мутность Р. резко возрастает и может наблюдаться, напр., опалесценция критическая. В узком интервале темп-р вблизи темп-ры инверсии фаз (заштрихованная область на рис. 18) в Р. обнаруживаются агрегаты разл. формы и состава: цилиндры, одно- и многослойные липосомы, ламеллы. Наблюдения в оптический и электронный микроскопы, а также данные малоуглового рассеяния рентг. излучения показали, что может возникать своеобразное подобие надмолекулярной организации микроэмульсий в интервале масштабов от неск. десятков нм до неск. мкм. Возможность возникновения развитой поверхности масло - вода вблизи темп-ры инверсии фаз связана с резким уменьшением величины поверхностного натяжения на этой границе в присутствии амфифильного вещества. Прямые измерения показывают, что добавление амфифильного вещества [а возможно, и спирта и (или) неорганич. соли] может привести практически к полному исчезновению поверхностного натяжения (т. н. ультранизкое поверхностное натяжение).
("масло в воде" : "вода в масле"). Вблизи темп-ры инверсии фаз мутность Р. резко возрастает и может наблюдаться, напр., опалесценция критическая. В узком интервале темп-р вблизи темп-ры инверсии фаз (заштрихованная область на рис. 18) в Р. обнаруживаются агрегаты разл. формы и состава: цилиндры, одно- и многослойные липосомы, ламеллы. Наблюдения в оптический и электронный микроскопы, а также данные малоуглового рассеяния рентг. излучения показали, что может возникать своеобразное подобие надмолекулярной организации микроэмульсий в интервале масштабов от неск. десятков нм до неск. мкм. Возможность возникновения развитой поверхности масло - вода вблизи темп-ры инверсии фаз связана с резким уменьшением величины поверхностного натяжения на этой границе в присутствии амфифильного вещества. Прямые измерения показывают, что добавление амфифильного вещества [а возможно, и спирта и (или) неорганич. соли] может привести практически к полному исчезновению поверхностного натяжения (т. н. ультранизкое поверхностное натяжение).Коллоидные растворы
К коллоидным растворам, в широком смысле, кроме мпцеллярных Р. (наз. также ассоциирующими коллоидами) относят разнообразные суспензии (взвеси) частиц, таких, как белковые глобулы, вирусы (см. Клеточные структуры), металлические и полимерные золи и т. п. Частицы в коллоидном Р. взаимодействуют посредством слабых сил: ван-дер-ваальсово притяжение конкурирует с отталкиванием заряженных поверхностей частиц (в условиях экранирования зарядов ионами Р.). В случае гидрофильных частиц (т. н. гидрофильные коллоиды), к к-рым относятся глинистые минералы, а также практически все водорастворимые вещества биол. происхождения, существ. роль играют т. н. гидратац. силы, обязанные искажению структуры растворителя вблизи поверхностей частиц (на расстоянии 1-3 нм).
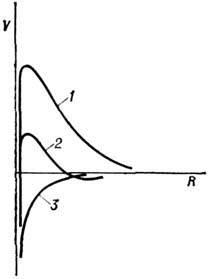
С течением времени частицы, совершающие в коллоидном Р. броуновское движение, слипаются - коагулируют. Скорость этого процесса сильно зависит от величины потенц. барьера на кривой потенц. энергии взаимодействия частиц в Р. (рис. 19), отделяющего состояние слипшихся частиц от состояния системы до коагуляции. Высота потенц. барьера уменьшается с ростом концентрации ионов Р. и обращается в нуль при нек-рой их критич. концентрации, зависящей от темп-ры, электрич. свойств поверхностей коллоидных частиц и зарядов ионов (кривая 2). При концентрациях ионов, больших критической, имеет место т. н. быстрая коагуляция, при меньших - медленная коагуляция с флуктуац. преодолением потенц. барьера.
Рис. 19. Потенциальная энергия двух коллоидных частиц, находящихся на расстоянии R друг от друга: 1- малая концентрация ионов; 2- концентрация ионов, соответствующая порогу коагуляции; з - большая концентрация ионов.
При коагуляции могут возникать как упорядоченные, так и неупорядоченные агрегаты. К первым относятся, напр., тактоиды, образующиеся в Р., содержащих кап-сиды вируса табачной мозаики, и по существу представляющие собой нематические фазы лиотропных жидких кристаллов. Упорядоченные кубические кристаллы возникают в Р., содержащих полимерные частицы (напр., шарики латекса диаметром 100-1000 нм). К неупорядоченным агрегатам относятся т. н. гели, к-рые образуются в коллоидных Р. разл. состава и представляют собой упругие твёрдые тела, имеющие трёхмерный каркас из слипшихся коллоидных частиц - цилиндров, пластинок и т. п. Пустоты в каркасе заполнены растворителем. Полимерные гели образованы макромолекулами, скреплёнными между собой к.-л. хим. агентами (напр., резина, набухшая в бензине, представляет собой Р. нитей каучука, "сшитых" в нек-рых точках серными мостиками). Содержание растворителя в геле может увеличиваться (набухание) или уменьшаться (осушение) при изменении темп-ры или (и) ионной силы Р. Как правило, набухание гелей ограничено, а избыток жидкости отслаивается в отд. фазу.
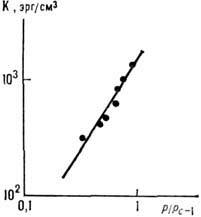
Модуль упругости геля зависит от концентрации "сшивок" между отд. частицами (рис. 20), причём конечный модуль сдвига появляется при нек-рой критич. концентрации "сшивок". Процесс образования геля из жидкого коллоида наз. фазовым переходом золь - гель.
Рис. 20. Зависимость модуля упругости К геля от концентрации "сшивок" между полимерными модулями [по оси абсцисс - параметр надкри-тичности ( р/р с- 1), где p- концентрация "сшивок", р с- её критич. значение].
Коллоидные Р. глинистых минералов, подобных монтмориллониту, обладают свойством тиксотропии, а именно: при механич. размешивании Р. представляет собой жидкость, а в состоянии покоя - гель. Трёхмерный каркас монтмориллонитовых гелей образован крис-таллич. алюмосиликатными пластинками (диаметром в неск. сотен нм, толщиной ок. 1 нм), несущими заряды - отрицательные на поверхностях и положительные на торцах. В геле соседние пластинки могут быть ориентированы как параллельно друг другу (т. н. плотные контакты; в этом случае расстояние между ними определяется балансом электростатических, ван-дер-ва-альсовых и гидратационных сил; рис. 21), так и перпендикулярно друг другу. В зависимости от содержания воды и разл. солей (глинистые минералы обладают свойством избират. связывания ионов из раствора, напр. ионов К +, Cs+, Ca++, Sr++ и др.) относит. доля контактов двух типов изменяется, а с ней изменяются и реологич. свойства гелей.
Рис. 21. Зависимость расстояния d между параллельными алюмосиликатными пластинками монтмориллонита от концентрации NaCl.
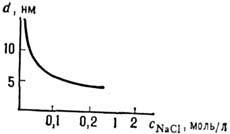
Особенность мн. коллоидных Р.- наличие значит. времён релаксации неравновесных состояний: даже в сравнительно разбавленных суспензиях релаксац. процессы могут длиться неделями и месяцами.
Лит.: Ландау Л. Д., Лифшиц E. М., Статистическая физика, ч. 1, 3 изд., М., 1976; Курс физической химии, 2 изд., т. 1, М., 1969; Сивухин Д. В., Общий курс физики, 2 изд., т. 2 - Термодинамика и молекулярная физика, М., 1979; Веденов А. А., Левченко Е. Б., Надмолекулярные жидкокристаллические структуры в растворах амфифштьных молекул, "УФН", 1983, т. 141, с. 3; Веденов А. А., Физика растворов, М., 1984; Микроэмульсии. Структура и динамика, под ред. С. Е. Фриберга, П. Ботореля, пер. с англ., М., 1990. А. А. Веденов, Е. Б. Левченко.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.