PROTACTINIUM
Le protactinium (Pa) est l’élément chimique de numéro atomique 91. Tous ses isotopes sont radioactifs; deux d’entre eux existent dans la nature associés à la géochimie de l’uranium. L’isotope de masse 231, émetteur 見 de période 1/2 = 34 000 ans, appartient à la famille radioactive 4n + 3 engendrée par l’uranium 235 et se trouve en quantité pondérable dans les minerais d’uranium (0,3 partie par million). Il donne naissance à l’actinium 227: d’où son nom. L’autre isotope naturel, 234Pa, en filiation avec 238U (famille 4n + 2), n’existe qu’à l’état de trace. Il a deux isomères émetteurs 廓–: UX2 (T1/2 = 1,17 min) et UZ (T1/2 = 6,6 h). C’est l’isotope UX2 qui a été séparé le premier de son parent 234Th (UX1), en 1913, par Kasimir Fajans et O. H. Göring; 231Pa a été découvert cinq ans plus tard indépendamment par Otto Hahn et Lise Meitner et par Frederick Soddy et John A. Cranston. On a préparé seize isotopes artificiels, dont l’un, 233Pa ( 廓–, 1/2 = 27 j), d’obtention aisée par irradiation neutronique du thorium 232, selon la séquence:

est particulièrement bien adapté comme indicateur dans les recherches chimiques sur l’élément. Il constitue l’étape intermédiaire de la transmutation de 232Th en 233U fissile. Dans cette transmutation, 231Pa est aussi formé. 232Th pourrait ainsi constituer un combustible nucléaire d’avenir. Les autres isotopes artificiels sont produits en irradiant le thorium ou l’uranium par des protons ou des hélions accélérés. Le protactinium 231 peut être synthétisé en irradiant l’ionium (230Th) aux neutrons (mais l’ionium est rare) ou plus simplement le thorium naturel, qui renferme aussi, outre 232Th, de l’ionium. Les réactions sont alors:
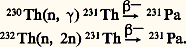
La quantité de 231Pa produite est de l’ordre de 10 grammes par tonne de thorium irradié pendant un an dans un réacteur nucléaire ayant un flux de 4 憐 1013 n . cm–2 . s–1. Cette voie a été utilisée en ex-U.R.S.S. Les propriétés physico-chimiques du protactinium ont été intensément utilisées jusque vers les années 1980, et cet élément suscite encore des recherches car c’est un élément clé de la classification périodique: c’est celui où apparaît le premier électron 5f.
Obtention et propriétés physiques
L’extraction du protactinium à partir de diverses fractions résiduelles résultant de l’attaque des minerais d’uranium ou du thorium irradié est une opération extrêmement difficile qui explique que la quantité de protactinium à l’état pur dans le monde ait été d’environ 200 g, dont 130 g ont été préparés en 1960 par des radiochimistes britanniques. Avant cette date, peu de laboratoires disposaient de cet élément en quantité pondérable. L’année 1960 a marqué le début d’une période extrêmement fertile pour la connaissance des propriétés de cet élément et de ses composés. Aristid von Grosse prépara le premier, en 1927, 2 mg d’oxyde Pa25, puis le protactinium, en 1934, par bombardement électronique de cet oxyde ou par dissociation thermique d’un halogénure sur un fil de tungstène. Depuis, plusieurs échantillons de quelques milligrammes ont été obtenus par réduction de Pa4 avec la vapeur de calcium ou de baryum à 1 400 0C. On a produit aujourd’hui le protactinium métallique extrêmement pur à l’échelle du gramme par dissociation de PaI5 sur un globule de tungstène chauffé par haute fréquence, PaI5 étant lui-même produit à partir du carbure PaC par attaque avec de l’iode (I2).
Le protactinium est un métal de couleur grise, de structure quadratique centrée (puis cubique centrée vers 1 170 0C), malléable, qui fond à 1 560 0C. Il se ternit rapidement à l’air en formant PaO, réagit avec l’hydrogène pour donner l’hydrure PaH3. Enfin, il est peu réactif vis-à-vis des acides chlorhydrique et fluorhydrique.
Propriétés chimiques en solution
En solution comme à l’état solide, le degré d’oxydation maximal du protactinium est + 5, conformément à sa position dans la classification périodique. On peut le considérer comme l’homologue supérieur du tantale. Il possède également la valence 4, peu stable, découverte en 1948 par M. Haïssinsky et G. Bouissières. PaIII pourrait exister à l’état de triiodure PaI3.
À l’échelle des indicateurs et en milieu aqueux perchlorique ou peu complexant, PaV donne lieu à la formation d’espèces de plus en plus hydrolysées avec l’augmentation du pH, allant probablement de Pa3+, en milieu très acide, à Pa(OH)–6, au-delà de pH 10. Le domaine d’existence de PaOOH2+ s’étend de pH 黎 1 à celui d’une solution d’acide perchlorique HCl4 4 à 5 M. L’augmentation de la concentration en élément conduit, en deçà de pH 1, à la formation de polymères solubles et, vers pH 黎 5, à la précipitation de Pa25 hydraté, composé insoluble en milieu basique et peu soluble dans l’acide perchlorique (face=F0019 黎 10–5 M). En revanche, la solubilité de PaV peut devenir importante en présence de complexants organiques ou minéraux, notamment de fluorure d’hydrogène HF. Dans les milieux fluorés, une seule espèce, Pa2–7, prédomine; ce qui est rare. La majorité des complexes identifiés dans les autres milieux sont des hydroxocomplexes renfermant la liaison Pa = O qui absorbe vers ou au-dessous de 210 nm.
PaIV est obtenu assez facilement par réduction de PaV avec l’amalgame de zinc ou un sel chromeux, ou encore par voie électrochimique. La dissolution de thorium métallique irradié aux neutrons dans un milieu d’acidité 1 M peut donner directement 233PaIV. Le cation Pa4+ existe en milieu perchlorique acide dilué en élément; il commence à s’hydrolyser dès pH 0 et se polymérise rapidement avec l’augmentation de la concentration en protactinium. Il est très complexable comme tous les ions M4+. La stabilité de PaIV à l’égard de l’oxydation dépend essentiellement de l’acidité, mais aussi de la nature des complexes dans lesquels il est engagé. Le spectre d’absorption de PaIV présente trois bandes caractéristiques de la structure 5f1 centrées vers 225,260 et 280 nm, quel que soit pratiquement le milieu dans lequel il est dissous.
La valeur du potentiel redox du couple PaV/PaIV est de l’ordre de 0,25 V en milieu HCl 6 M. Le protactinium peut être déposé sur une cathode de métal noble (Ag, Au, Pd, Pt et Rh) vers 漣 1,2 V à partir d’une solution fluorhydrique neutre ou spontanément sur le zinc. En milieu carbonique, il conduit à la formation d’un peroxyde anodique. La polarographie de Pa a été développée en milieux complexants de pH voisin de 7 et dans l’acétonitrile. Deux vagues polarographiques irréversibles apparaissent. La première, vers 漣 1,29 V en milieu fluorhydrique ou 漣 0,97 V dans le sulfate d’ammonium, est due à la réduction de PaV en PaIV. La seconde, située vers les potentiels plus négatifs, correspond certainement à la réduction du solvant; en tout cas, aucune indication ne permet de conclure quant à l’existence d’une valence inférieure à 4, même en milieu organique. Diverses considérations théoriques récentes ont permis de calculer les potentiels redox des couples mettant en jeu les degrés d’oxydation 0, 3, 4 et 5.
PaV et PaIV sont extraits de milieux aqueux variés dans diverses phases organiques par une très grande variété de réactifs. PaIV, contrairement à PaV, ne peut être échangé sur résine anionique en milieu HCl. L’extraction par solvant et la fixation sur résine ont été largement utilisées, tant pour la séparation de Pa d’avec ses voisins ou homologues que pour l’étude de ses propriétés chimiques en solution. Enfin, le protactinium se partage en faveur de la phase métallique dans des systèmes biphasés composés de milieux salins fondus et de bismuth ou d’aluminium liquide.
Composés
De nombreux composés solides de PaIV et de PaV ont été isolés par voie humide, par voie sèche ou bien préparés en milieu non aqueux. On peut obtenir à partir des solutions aqueuses de PaV: PaF5 . 2H2O; les séries de sels doubles MPa6, M2Pa7 et M3Pa8 (M 令 alcalin); l’oxyde Pa25 . n H2O; le peroxyde Pa29 . 3H2O; le peroxyprotactinate NaPa6 . n H2O; l’acide H3PaO(SO4)3; le nitrate PaO(NO3)3 . n H2O; des phosphates et oxyphosphates complexes tel PaO(H2P4)3 . 2H2O et enfin l’oxalate PaO(C24)OH . n H2O. À partir des solutions de PaIV, on aboutit à Pa4 . n H2O et à Pa2S4 . n H2O. La chimie par voie sèche s’est développée plus tardivement que celle des milieux aqueux: tous les pentahalogénures et tétrahalogénures sont connus, et également des oxyhalogénures: Pa2OX8(X = F, Cl), PaOX3(X = Cl, Br, I), PaO2X (X = Br, I) pour PaV, et PaOX2 (X = Cl, Br, I) pour PaIV. Le composé Pa417 et des fluorures doubles d’éléments alcalins Pa4 . n MF ont été isolés. De très nombreux halogéno-complexes de PaIV et PaV ont été obtenus. Les plus simples sont du type M2PaX6(X = F, Cl, Br, I; M = alcalin, ion ammonium quaternaire) et M Pa X6, M3 Pa X8. De même, on a isolé et caractérisé de très nombreux composés de coordination de PaIV et PaV et on peut dire qu’il existe une très riche chimie organométallique de cet élément, particulièrement intéressante. Les composés sont essentiellement synthétisés à partir des halogénures, véritables composés clés de la chimie du protactinium en milieu non aqueux. Les oxydes Pa25 et Pa2 sont bien connus ainsi que certaines phases non stoechiométriques. À partir des oxydes simples, on peut préparer quantité d’oxydes mixtes avec des éléments monovalents à pentavalents. Enfin, plusieurs phosphates sont connus: Pa(PO3)4, PaP27 de PaIV, et une série de phosphates de PaV: le perrhenate PaO(ReO4)3, le nitrure Pa1,1, les carbures PaC et PaC2, l’hydrure PaH3 et l’oxysulfure PaOS. Des composés intermétalliques entre Pa et As, Sb, Rh, Ir et Pt peuvent être obtenus.
Curieusement, certaines propriétés du protactinium sont aujourd’hui mieux connues que celles de ses homologues inférieurs, le tantale et le niobium. D’une façon générale, les composés de PaIV sont, d’un point de vue fondamental, plus intéressants que ceux de PaV, car leurs propriétés thermodynamiques, magnétiques et spectroscopiques peuvent être expliquées à partir de la structure électronique 5f1 de l’ion Pa4+, pour laquelle on peut effectuer des calculs encore significatifs.
protactinium [ prɔtaktinjɔm ] n. m. ♦ Chim. Élément radioactif (Pa; no at. 91; m. at. 231), de la série des actinides. L'isotope de plus longue vie du protactinium a une période de 32 500 ans.
● protactinium nom masculin Élément radioactif de numéro atomique 91 (symbole Pa). [Il a été découvert en 1917. Son isotope 231 a pour période 32 500 ans et se désintègre par émission de particules alpha pour donner de l'actinium.]
protactinium
n. m. CHIM élément radioactif (symbole Pa) appartenant à la famille des actinides, de numéro atomique Z = 91.
protactinium [pʀɔtaktinjɔm] n. m.
ÉTYM. V. 1918; de prot-, et actinium.
❖
♦ Chim. Élément radioactif (symb. Pa; no at. 91; masse at. 231; période 34 000 ans), qui appartient à la famille de l'actino-uranium (⇒ Uranium).
Encyclopédie Universelle. 2012.