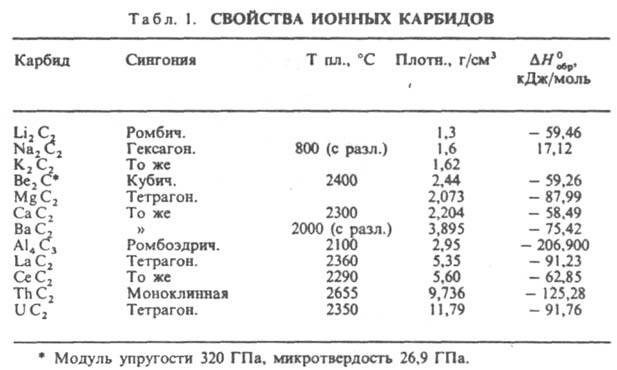
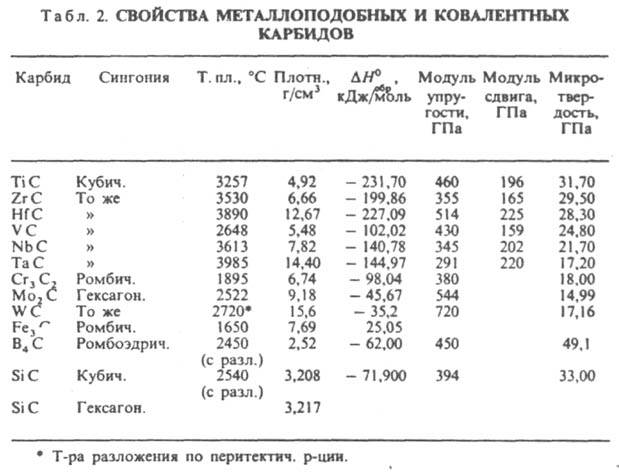
К. щелочных металлов кристаллизуются в решетках типа графита, атомы металлов размещаются между углеродными слоями, построенными из гексагoн. сеток. К. щел.-зем. металлов кристаллизуются в гранецентрир. тетрагон. решетке типа СаС 2, карбиды РЗЭ, монокарбиды актиноидов и переходных металлов в гранецентрир. кубической типа NaCl, сесквикарбиды актиноидов М 2 С 3 в объемноцентрир. кубич. решетке типа Рu2 С 3. Ионные К. щелочных металлов разлагаются при т-ре ок. 800 °С, К. щел.-зем. металлов в интервале 1800-2300°С, ковалентные К. и металлоподобные разлагаются и плавятся при более высоких т-рах. В периодич. системе в пределах группы т-ры плавления К. возрастают с увеличением порядкового номера металла и обычно в 1,5-2 раза выше, чем т-ры плавления соответствующих металлов. Это обусловлено высокой прочностью связи М-С. Металлоподобные К. обладают металлич. проводимостью, для них характерен положит. температурный коэф. r. Для сесквикарбидов величина r (достигает 500 мкОм. см) примерно на порядок выше, чем для дикарбидов и монокарбидов (20-50 мкОм. см). Дикарбиды РЗЭ также обладают металлич. св-вами. Карбиды В и Si, а также Be, Mg и Аl - полупроводники. Мех. св-ва К. зависят от прочности хим. связи, степени ее ковалентности и межатомного расстояния. наиб. высокой твердостью обладают карбиды В, Si, Be, а также монокарбиды РЗЭ и переходных металлов; твердость последних уменьшается при переходе от К. подгруппы IVа к К. подгруппы VIa. Все К. при комнатной т-ре - хрупкие в-ва, их пластич. деформация возможна в условиях всестороннего сжатия при очень высоких напряжениях. Ионные К. разлагаются водой с образованием метана, ацетилена, метилацетилена или смеси углеводородов и гидроксида металла, напр.:
Аl4 С 3 + 12Н 2 О : 4Аl(ОН)3 + 3СН 4;
Na2C2 + 2Н 2 О : 2NaOH +С 2 Н 2;
Mg2C3 + 4Н 2 О : 2Mg(OH)2 + С 3 Н 4.
Ковалентные и металлоподобные К. не разлагаются водой и большинством минер. к-т и щелочей. Получают К. из элементов, восстановлением оксидов металлов, газофазным способом, металлотермически. Синтез из элементов осуществляют при высоких т-рах в вакууме или инертной атмосфере. В зависимости от технол. параметров процесса образуются порошки с размером частиц от 0,5 мкм до 2 мм. Синтез может осуществляться в режиме горения, т. к. в результате р-ции выделяется большое кол-во тепла, либо в плазме при 5000-10000 К в дуговых, высокочастотных и сверхчастотных плазмотронах. В результате быстрого охлаждения из парогазовой смеси элементов в плазмообразующем газе (Аr или Не) образуются ультрадисперсные порошки с размерами частиц 10-100 нм. Восстановлением оксидов металлов производят наиб. важные соед . - бора карбиды, кремния карбиды, а также вольфрама карбиды, титана карбид и др. К. переходных металлов. Газофазным способом получают К. из хим. соед., к-рые испаряются, разлагаются, а затем восстанавливаются и взаимод. друг с другом, напр.:
2МСl + 2ССl4 + 5Н 2 : 2МС + 10НСl.
Чаще всего этот синтез осуществляют в плазме, получая дисперсные порошки. По металлотермич. способу оксиды металлов восстанавливают металлами (Mg, Al или Са) в присут. углерода, напр.:
МО + С + Мg : МС + МgО.
Особо чистые К., не содержащие кислорода и азота, синтезируют взаимод. С и металла в расплаве др. металла или сплава, напр. TiC получают в сплаве Fe Ni. Из ионных К. наиб. важен кальция карбид СаС 2, из ковалентных В 4 С и SiC. Металлоподобные К. упрочняют чугун и сталь [Fe3C, (Fe,Cr)3C, Fe2W2C, (Fe,Cr,Mo)23C6], они являются основой твердых вольфрама сплавов(WC, TiC, WC, TiC, TaC, WC) и др. твердых сплавов (TiC, VC, Сr3 С 2, ТаС), используемых для обработки металлов резанием. К. применяют также как восстановители, раскислители и катализаторы, они входят в состав жаропрочных и жаростойких композиционных материалов, в т. ч. керметов. Лит.: Стормс Э., Тугоплавкие карбиды, пер. с англ., М., 1970; Гольдшмидт X., Сплавы внедрения, пер. с англ., в. 1-2, М, 1971, Тот Л., Карбиды и нитриды переходных металлов, пер. с англ., М, 1974. Самсонов Г. В., Упадхая Г. Ш., Нешпор В. С., Физическое материаловедение карбидов, К., 1974, Высокотемпературные карбиды, под ред. Г. В. Самсонова, К, 1975, Карбиды и сплавы на их основе, под ред. Г. В. Самсонова, К, 1976, Свойства, получение и применение тугоплавких соединений, Справочник, под ред. Т. Я. Косолаповой. М, 1986, П. С. Кислый.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.