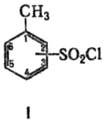
(хлорангидриды толуол-сульфокислот, толуолсульфонилхлориды; ф-ла I), мол. м. 190,64. Различают 2-, 3- и 4-Т., соотв. о-, м- и n-Т. Для о-Т. т. кип. 126°С/10мм рт. ст., для м-T. т. пл. 11,7°С, для л-Т. т. пл. 67,5 °С, т. кип. 145-146°С/15мм рт. ст.; технический n-Т.-серое кристаллич. в-во с т. пл. 65,5 °С, миним. содержание осн. в-ва 95%.
Т. гидролизуются водой в мягких условиях до толуолсульфокислот, при действии перегретого водяного пара в присут. угля разла гаются на толуол, соляную и серную к-ты.
При восстановлении Т. щелочными металлами либо Zn в нейтральной, щелочной или уксуснокислой среде образуются соли сульфиновых к-т, при восстановлении Zn в НСl или Н 2SО 4 -тиокрезолы; последние образуются также при действии HI в СН 3 СООН. Сульфиды щелочных металлов восстанавливают Т. в зависимости от условий в толуолсульфиновые к-ты или соли толуолтио-сульфокислот.
Окисление л-Т. хромовой к-той (в смеси с СН 3 СООН и ее ангидридом) приводит к 4-хлорсульфонилбензойной к-те; при действии РbО 2 в КОН Т. теряет атом S и образуются бензойная и n-гидроксибензойная к-ты.
Взаимодействие Т. с NH3 дает толуолсульфамиды, а с аминами-N-замещенные толуолсульфамиды, на последней р-ции основан метод разделения первичных, вторичных и третичных аминов (р-цию проводят в водном р-ре NaOH).
Р-ции Т. со спиртами, фенолами или енолами в присут. щелочи или амина приводят к соответствующим эфирам толуолсульфокислот. При взаимодействии Т. с ароматич. углеводородами в присут. к-т Льюиса образуются диарил-сульфоны. Последние м. б. получены также при взаимодействии Т. с металлоорг. соединениями, однако при этом протекают побочные р-ции восстановления сульфохлори-дов.
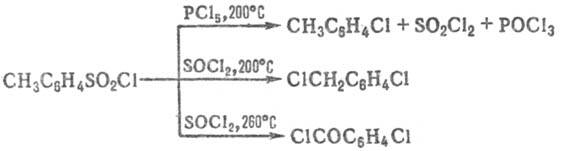
При термолизе Т., особенно в присут. хлорирующих агентов, происходит элиминирование сульфогруппы:
n-Т. хлорируется, нитруется и сульфируется в орто- положение к группе СН 3.
Осн. метод получения Т.-взаимод. толуола с избытком хлорсульфоновой к-ты; от условий р-ции зависит соотношение изомеров в смеси: при 0-5 °С смесь содержит 60% л-Т. и 37% o-Т., а при 70-80°С-95% n-Т., кол-во мета- изомера, не превышает 4%. Обычно применяют смесь орто- и пара- изомеров, для разделения изомеров используют метод вымораживания n-Т. с послед. перегонкой o-T.
Т. могут быть получены р-цией SO2Cl2 с толилмагний-бромидом, хлорированием толуолсульфокислот или их солей (хлорирующие агенты-РСl5, РОСl3, РСl3, Сl2 и др.), окислит. хлорированием тиокрезолов, дитолилсульфидов, толуолсульфиновых к-т и их солей.
Т.-полупродукты в синтезе биологически активных в-в, пластификаторов, реагенты для орг. синтеза.
Т. раздражают слизистые оболочки глаз и дыхательных путей.
Лит.: Ворожцов Н. Н., Основы синтеза промежуточных продуктов и красителей, 4 изд., М., 1955; Оае С., Химия органических соединений серы, пер. с япон., М., 1975, с. 482, 496; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 519, 522, 529; Houben-Weyl, Methoden der organischcn Chemie, Bd 9, Stuttg., 1955, S. 563-96. Ю. Г. Шермолоеич.
Химическая энциклопедия. — М.: Советская энциклопедия. Под ред. И. Л. Кнунянца. 1988.