SOUFRE
Le soufre est connu depuis les temps les plus reculés. Il est cité dans la Bible et dans L’Odyssée . Son nom vient du sanscrit sulvere qui a donné sulfur en latin. Ses usages anciens furent la désinfection et la poudre noire. Les impuretés toujours présentes dans le soufre ont conduit les chimistes à lui supposer longtemps les compositions les plus variées: bitume pour Nicolas Lemery (1645-1715); mélange d’acide sulfurique et d’une substance volatile pour Johann Kunckel (1630 env.-1703 env.); cire naturelle pour de nombreux autres; il est enfin considéré comme élément par Lavoisier et par Gay-Lussac, ce qui n’empêche pas Davy de lui attribuer une composition analogue à celle des hydrocarbures. Le soufre formerait 0,06 p. 100 du poids de la croûte terrestre jusqu’à 20 km de profondeur. Quoique faisant partie, dans le tableau de Mendeleïev, du même groupe que l’oxygène, il s’en distingue par une variété exceptionnelle d’aspects et de réactions.
Par action du soufre élémentaire sur des substances organiques, beaucoup de composés, sulfurés ou non, peuvent être obtenus, avec formation, en général, d’hydrogène sulfuré. Un cas particulièrement important de ces réactions est la vulcanisation du caoutchouc qui, par action du soufre sur un caoutchouc naturel, fournit un produit ayant de meilleures propriétés mécaniques. On pense que la vulcanisation provient d’une réticulation du caoutchouc naturel par la formation de liaisons chimiques, par l’intermédiaire d’atomes de soufre, entre les macromolécules qui le constituent.
Les types de composés organiques sulfurés sont très nombreux, et, si l’analogie du soufre et de l’oxygène, qui appartiennent à la même famille de la classification périodique des éléments, peut être invoquée pour décrire certains dérivés sulfurés, ce n’est pas toujours le cas et de très loin.
La chimie organique du soufre comprend, en effet, nombre de composés qui n’ont aucune contrepartie dans la chimie organique des dérivés oxygénés.
L’analogie se manifeste essentiellement quand le soufre est divalent, encore qu’il y ait, là aussi, de notables différences. Les dérivés du soufre quadrivalent peuvent être rapprochés de l’anhydride sulfureux S2, et les dérivés du soufre hexavalent de l’anhydride sulfurique S3.
La description du métabolisme des diverses substances contenant du soufre nécessite une extrême schématisation. En effet, le soufre existe dans la nature et dans les organismes vivants (animaux, végétaux et micro-organismes) sous des formes très variées, tant minérales (sulfures métalliques, sulfates) qu’organiques: acides aminés (méthionine et cystéine), vitamines et coenzymes (thiamine, coenzyme A et biotine), antibiotiques. Il existe également dans le cartilage des animaux supérieurs sous forme d’acide chondroïtine-sulfurique. Or, les voies de synthèse ou de dégradation de ces substances ne sont pas les mêmes dans tous les organismes considérés.
Le soufre est un produit d’une grande importance industrielle (cf. acide SULFURIQUE): la production minière annuelle mondiale de soufre élémentaire était de 35,2 millions de tonnes en 1979 et elle croît constamment. Les modes de production utilisés sont nombreux, depuis l’extraction à la vapeur jusqu’au traitement des pétroles en passant par l’oxydation des pyrites. Cette diversité d’origine, donc de prix de revient, complique l’équilibre entre la production et la consommation. Aussi, malgré les efforts réalisés pour améliorer cette situation, le marché du soufre est-il instable.
1. L’élément soufre
Propriétés physico-chimiques
Le soufre possède un atome dont la couche externe contient six électrons. Cette couche se divise en deux sous-couches qui comprennent respectivement deux et quatre électrons. En faisant l’acquisition de deux électrons, le soufre se comporte comme un élément divalent électronégatif; en perdant des électrons, il est électropositif. Il peut être alors tétravalent ou hexavalent. Le soufre retient moins bien que l’oxygène ses électrons de la couche externe; il les partage volontiers avec d’autres éléments ou avec d’autres atomes de soufre. Il en résulte des molécules qui ont de 2 à 106 atomes de soufre. Celles-ci forment des chaînes ou des circuits élémentaires sans branches latérales. Le lien qui unit ces atomes était mal compris jusqu’à ces derniers temps. La spectroscopie par électrons apporte enfin un espoir de solution.
Le soufre solide se présente sous un grand nombre d’état allotropes. Comme le sujet est encore controversé, on ne citera ici que les allotropes bien établis.
Variétés allotropiques
Les cycles à six atomes forment des cristaux rhomboédriques (soufre 福). Les cycles à huit atomes donnent lieu à une grande variété de cristaux: orthorhombiques, ou soufre 見, forme habituelle du soufre stable jusqu’à 96 0C; monocliniques, ou soufre 廓, qui est la forme stable courante entre 96 0C et le point de fusion du soufre (112 0C); cristaux monocliniques 塚 qui apparaissent dans certaines conditions en feuilles brillantes fondant à 106,8 0C. Chauffé jusqu’à l’obtention d’un liquide de haute viscosité, puis trempé et extrait au sulfure de carbone, le soufre donne un produit fibreux ou plastique. Le résidu correspond au soufre insoluble, ou soufre 諸. Par action de l’hydrogène sulfuré sur l’acide sulfureux, on obtient un soufre colloïdal hydrophile; par condensation de la vapeur de soufre dans l’eau, on obtient un soufre colloïdal hydrophobe. Le comportement du soufre à haute pression a été étudié par Percy W. Bridgman jusqu’à 98 kbar à température normale, et jusqu’à 49 kbar à 125 0C. On n’observe pas de modification de structure, mais les propriétés mécaniques sont altérées. La viscosité du soufre liquide varie avec la température comme l’indique la figure 1. L’accroissement brusque de viscosité est expliqué, selon les théories classiques des polymères, par la formation de longues chaînes de soufre. Le soufre liquide est un solvant qui a été utilisé comme milieu de réaction pour produire du soufre à partir d’hydrogène sulfuré et d’anhydride sulfureux. Le soufre gazeux est un mélange de molécules à deux, quatre, six et huit atomes. Les principaux solvants du soufre sont le sulfure de carbone, le benzène, le toluène, le chlorobenzène, l’aniline, la pyridine, le phénanthrène, le chlorure de soufre. Le soufre est un élément qui se combine à presque tous les autres. Avec l’hydrogène, il donne l’acide sulfhydrique, plus communément appelé hydrogène sulfuré. En pratique, on procède à 500 0C en présence d’un catalyseur. Le soufre réagit avec l’oxygène pour donner les oxydes SO, S2, S3, par exemple. Le S4 est obtenu par l’action de l’ozone. On sait comment l’acide sulfurique est obtenu par la réaction de l’anhydride sulfurique S3 avec l’eau. Avec le phosphore (rouge de préférence pour éviter les explosions), le soufre donne quatre corps. Avec le carbone, on obtient le sulfure de carbone (CS2); avec l’oxyde de carbone, l’oxysulfure COS. Le soufre se combine au silicium, au germanium, à l’étain et, bien entendu, à tous les métaux pour donner des sulfures. Cependant, la combinaison avec l’or ou l’iridium n’est pas directe. L’importance de la réaction du soufre avec les corps organiques est grande: plusieurs aminoacides essentiels contiennent du soufre, la synthèse des protéines suppose un pont 漣S 漣S 漣, la vitamine B contient du soufre. Les carences en soufre des animaux et des plantes sont connues.
Industrie du soufre
Le soufre industriel, qui se présente le plus souvent sous forme de paillettes solides, est transporté de plus en plus à l’état liquide sur d’aussi longues distances que la traversée de l’Atlantique. Certains besoins spéciaux ont conduit à l’élaboration de soufre sublimé, soufre broyé, soufre micronisé, soufre en canons et en pains. L’agriculture utilise les soufres fluents, le soufre mouillable, le soufre mouillable micronisé, le soufre colloïdal, les polysulfures et les mélanges contenant du soufre. L’industrie emploie, à côté du soufre liquide ou en paillettes, le soufre fluent, le soufre insoluble dans le sulfure de carbone et les soufres imprégnés. Le soufre brut est généralement d’une grande pureté (aisément 99,9 p. 100). Il doit être exempt de substances organiques et d’arsenic quand il sert à la synthèse d’acide sulfurique. Les substances organiques salissent les filtres et l’arsenic empoisonne les catalyseurs d’oxydation. La transformation du soufre brut se fait, d’abord, par raffinage, qui consiste en une sublimation à température de distillation, et, ensuite, par un broyage qui donne le soufre micronisé. Le soufre sublimé se présente sous la forme de particules sphériques et creuses dénommées utricules. Ces utricules sont isolés ou réunis en chapelets. Le soufre sublimé a une densité d’environ 0,5 (la densité normale est de 2). Les soufres fluents ont été traités pour éviter les forces électrostatiques. Obtenu par traitement avec des produits mouillants ou dispersants, le soufre mouillant permet la mise en suspension du soufre dans l’eau.
Sources et production du soufre
Aujourd’hui, le soufre est extrait des gisements où il est à l’état natif, des sulfures minéraux appelés pyrites, des gaz naturels contenant de l’hydrogène sulfuré et des pétroles bruts. La préparation du soufre à partir des calcarones a pratiquement disparu. Les sulfates de calcium et de fer ne servent plus guère à la fabrication de l’anhydride sulfureux, qui peut être lui-même une source de soufre. Les principaux pays producteurs de soufre étaient, en 1979: les États-Unis (10,5 Mt de soufre élémentaire), le Canada (8,4 Mt), la Pologne, l’U.R.S.S., la France, le Mexique, le Japon.
Deux procédés principaux sont utilisés pour traiter le soufre à l’état natif. Dans le premier, le minerai est concassé, broyé en pulpe épaisse, puis traité par flottation (cf. MÉTALLURGIE - Métallurgie extractive) et concentré. Une purification finale par fusion et éventuellement par filtration du soufre fondu donne un soufre titrant 99,5 p. 100. Dans le second procédé, dit procédé Frasch du nom de son inventeur, adopté au Texas dès 1912, le soufre est fondu sous terre par des jets de vapeur sous pression et remonté dans un tube par air comprimé. Le schéma de la figure 2 illustre ce principe. Le procédé Frasch est plus économique que celui de la flottation. Il donne aussi un produit plus pur.
Les pyrites, grillées à 400-500 0C, réagissent avec l’air selon la réaction:

En oxydant davantage, on obtient de l’anhydride sulfureux, qui est utilisé pour la fabrication de l’acide sulfurique. Le grillage s’effectue sur grille ou en lit fluide.
Avec certains minerais, un traitement est nécessaire pour éliminer l’arsenic. L’ancien procédé Orkla , aujourd’hui abandonné, réduisait l’anhydride sulfureux en soufre par réactions avec le carbone. Dans le procédé Outokumpu , les pyrites sont réduites en fines particules qui sont fondues à 1 250-1 425 0C. Ces particules descendent dans l’appareil en dégageant de la chaleur et en provoquant un accroissement du volume des gaz. On obtient du soufre et du sulfure FeS fondu. Le FeS est fluidisé et tombe lentement. Les traces d’hydrogène sulfuré et d’anhydride sulfureux sont éliminées. Un lavage au lait de chaux absorbe l’arsenic. Finalement, on a du soufre et du FeS.
Les procécés qui fabriquent le soufre à partir de l’hydrogène sulfuré sont fondés sur les réactions découvertes par Karl Claus, mais nettement perfectionnées depuis. L’oxygène ou l’anhydride sulfureux réduisent l’hydrogène sulfuré, entre 100 et 350 0C, en présence d’un catalyseur (bauxite, alumine, charbon actif, par exemple), en donnant du soufre et de l’eau. Ces procédés sont pratiquement aussi importants que le procédé Frasch.
L’extraction à partir des pétroles n’a pas été rentable jusqu’ici, mais elle est imposée par les lois sur la pollution de l’air. Pour réduire la quantité de S2 rejetée dans l’atmosphère par les moteurs à essence, il faut réduire la quantité de soufre contenue dans cette essence. La désulfuration peut être obtenue par hydrogénation sous pression en présence d’un catalyseur (cobalt ou molybdène). Le soufre est alors produit par une réaction de Claus. La combustion des charbons et des fuels donne de l’anhydride sulfureux que l’on peut absorber de diverses manières, le plus couramment par l’ammoniaque. On obtient ainsi du sulfate d’ammonium, qui, bon marché, est peu attrayant. Comme la quantité de S2 ainsi produite est énorme, on pourrait avoir là une nouvelle source de soufre si l’on trouvait un procédé meilleur.
Économie et avenir du soufre
La consommation de soufre dans le monde varie avec le niveau industriel des pays. Le tableau résume la situation en 1968, qui n’a guère changé depuis. Les chiffres exceptionnellement élevés du Canada, de la Finlande et de la Suède s’expliquent par leur fabrication de cellulose, grande consommatrice de sulfure de carbone. La distribution de cette consommation à l’échelle mondiale était la suivante en 1966: acide sulfurique, 75,5 p. 100; sulfure de carbone, 6,2 p. 100; papier, 8,9 p. 100; soufres pour l’agriculture, 2,8 p. 100. La comparaison de la production à la consommation donne lieu à un graphique intéressant (fig. 3): cycliquement, la production dépasse la consommation; il en résulte une diminution de prix et un accroissement de la consommation, et l’équilibre est rompu en sens inverse. Un accroissement brutal de la production a eu lieu après la découverte des nappes de gaz sulfureux au Canada; un phénomène analogue se produirait si l’on se montrait plus rigoureux en matière de pollution de l’air.
Un effort considérable est fait pour trouver de nouveaux emplois du soufre et rétablir l’équilibre en augmentant la consommation. On entrevoit une série d’usages importants dans un avenir prochain. L’addition du soufre à l’asphalte, dans des conditions contrôlées pour éviter un dégagement d’hydrogène sulfuré, améliore les qualités de cet asphalte et permet d’utiliser des agrégats de qualité inférieure. D’autre part, les polysulfures améliorent la surface de l’asphalte. On a aussi fabriqué des mousses de soufre qui sont à la fois bon marché et d’une résistance mécanique exceptionnelle. Ces mousses pourraient être employées dans les fondations de routes pour éviter l’effet du gel et dans les systèmes d’isolation des méthaniers. Elles peuvent être rendues incombustibles, ce qui permet d’en envisager l’emploi dans le bâtiment. L’imprégnation de certains matériaux par le soufre améliore leur résistance au gel et leur résistance mécanique. On a ainsi pu produire des carreaux de céramique bon marché. Des tuyaux en béton, qui résistent à la corrosion intense des égouts, ont été aussi réalisés. Enfin, on a construit un accumulateur soufre-sodium qui permet d’emmagasiner assez d’énergie pour alimenter une voiture électrique pendant plusieurs centaines de kilomètres, mais cette batterie est encore fragile.
2. Composés organiques
Dérivés du soufre bivalent
Thiols, ou mercaptans
Les thiols, ou mercaptans, ont pour formule générale R 漣SH; ce sont les analogues sulfurés des alcools (R: aliphatique) et des phénols (R: aromatique) largement utilisés industriellement en agrochimie et en pharmacochimie.
Les termes les plus légers ont une odeur forte, généralement repoussante, mais, quand le nombre d’atomes de carbone de la molécule dépasse 12, l’odeur s’atténue et même disparaît pour les termes les plus lourds.
Les thiols se rencontrent dans de nombreux milieux organiques. On en trouve notamment dans les essences d’ail (prop-2-ènethiol, ou allyl mercaptan), de pamplemousse (p-menthènethiol) et dans l’arôme de viande grillée (furanethiols). Les produits pétroliers contiennent de nombreux mercaptans.
Les thiols peuvent être obtenus par addition d’hydrogène sulfuré à un alcène, vers 160 0C:
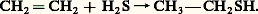
On les prépare également par action de l’hydrogène sulfuré sur les alcools ou dérivés halogénés correspondants. L’acide mercaptoacétique ou thioglycolique (HS 漣CH2 漣 C2H) utilisé en cosmétologie et pour la stabilisation des polymères est ainsi préparé à partir de l’acide chloroacétique (Cl 漣 CH2 漣C2H). Les thiols peuvent aussi être produits par réduction d’acides sulfoniques ou de disulfures. Certaines de ces méthodes sont utilisées dans l’industrie. La synthèse de thiols à partir de la thio-urée est également possible:

En milieu alcalin, le sel de S-alkyl thio-uronium libère une S-alkyl thio-urée qui, chauffée en milieu aqueux, donne le thiol et de la cyanamide:

Ils se distinguent des alcools correspondants par une plus nette acidité de l’hydrogène lié au soufre, ce qui correspond au fait que l’hydrogène sulfuré est plus acide que l’eau. Les thiols de faible masse moléculaire sont solubles dans l’eau en milieu basique.
Le groupe 漣SH, caractéristique des thiols, est parfois associé à d’autres fonctions chimiques et est souvent désigné par le préfixe «mercapto». Il existe dans des aminoacides importants, constituants de protéines ou d’antibiotiques.
La cystéine, dont la formule est HS 漣 CH2 漣CH(NH2) 漣C2H, et le disulfure correspondant, [HC2 漣CH(NH2) 漣CH2 漣S]2, sont des constituants des protéines.
Sulfures
Les sulfures R 漣S 漣R correspondent aux oxydes (éthers-oxydes) R 漣O 漣R , mais le soufre est un meilleur nucléophile que l’oxygène, c’est-à-dire qu’il est plus efficace pour se substituer à des groupes ou des atomes électronégatifs comme le brome et l’iode fixés sur une molécule organique. Il en résulte que les ions sulfonium R3S+ sont d’un accès plus aisé que les ions oxonium R3+.
Les sulfures se rencontrent dans beaucoup de composés naturels. Le sulfure de méthyle a été détecté dans diverses essences végétales et constitue un sous-produit de la fabrication des pâtes à papier par la «méthode au sulfate» ou le procédé Kraft. De nombreux sulfures se trouvent dans les produits pétroliers distillés mais peuvent souvent, comme dans la préparation de la pâte à papier, provenir des réactions chimiques en cours de traitement et ne pas exister dans la matière première.
Un sulfure cyclique C4H8S (tétrahydrothiophène) est un produit industriel important servant à «odoriser» les combustibles pétroliers gazeux pour permettre une détection rapide des fuites éventuelles.
Les sulfures (RSR ) sont généralement obtenus par alkylation d’un thiolate alcalin, ou du sulfure de sodium pour les composés symétriques (R=R ):
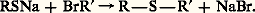
La méthionine, de formule:

joue un rôle important dans la nutrition et la croissance des êtres vivants, animaux et bactéries. Elle est préparée industriellement en gros tonnage, à partir du méthylmercaptan (ou méthanethiol), pour l’alimentation animale.
Disulfures et polysulfures
Entre autres propriétés, les thiols se distinguent des alcools par la possibilité de former des disulfures par oxydation douce:
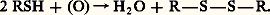
Leurs analogues oxygénés dérivés des alcools, les peroxydes R 漣O 漣O 漣R, sont peu stables et préparés de manière différente.
Des molécules possédant des groupements sulfures et disulfures sont responsables de certains arômes naturels: fruit de la passion, café, cacahuète, asperge, etc. À côté des disulfures, on connaît les polysulfures R 漣 Sn 漣R (pouvant contenir jusqu’à une dizaine d’atomes de soufre) utilisés comme additifs pour lubrifiants ou pour la sulfuration d’oxydes métalliques, catalyseurs en pétrochimie.
Dérivés sulfurés des aldéhydes et des cétones
En faisant agir des thiols sur les aldéhydes ou sur les cétones, en milieu acide, on obtient aisément des dithioacétals R CH(SR)2 ou R R C(SR)2. Les thioaldéhydes RCH=S et les thiocétones RR C=S sont plus difficiles d’accès que les composés oxygénés correspondants.
Ces thioaldéhydes et thiocétones sont souvent aisément polymérisables, ce qui rend leur étude délicate. Toutefois, on connaît un bon nombre de thiocétones aromatiques telles que la thiobenzophénone C6H5 漣CS 漣C6H5, d’une remarquable couleur bleue.
La réactivité du groupement C=S (thiocarbonyle) est souvent très différente de celle du groupement C=O (carbonyle) de leurs analogues oxygénés. En particulier, l’orientation de l’addition d’un organométallique peut être parfois totalement inversée (addition thiophile):
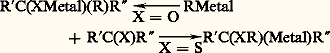
et le groupement thiocarbonyle peut être facilement oxydé en sulfines R R C=S=O plus ou moins stables par action de peroxydes.
Dérivés sulfurés d’acides carboxyliques
Aux acides carboxyliques R 漣COOH et à leurs esters R 漣COOR correspondent des composés sulfurés dans lesquels un atome d’oxygène a été remplacé par un atome de soufre. Dans le cas des esters, les deux structures possibles R 漣CS 漣OR et R 漣 CO 漣SR sont facilement accessibles. On connaît aussi des corps où les deux atomes d’oxygène ont été remplacés: les acides et les esters dithiocarboxyliques R 漣CS 漣SH et R 漣CS 漣SR . Les xanthates sont des dithiocarbonates formés par action du sulfure de carbone sur des dérivés alcalins d’alcools:

La cellulose est un polyalcool macromoléculaire à partir duquel on peut obtenir des xanthates qui servent à la préparation de fibres (viscose) ou de films (cellophane).
Le sulfure de carbone réagit sur l’ammoniac et sur les amines primaires ou secondaires en donnant des acides dithiocarbamiques:

Ces acides sont aisément oxydables en disulfures de thiocarbamoyle, connus sous le nom de disulfures de thiurame:
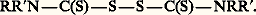
Ceux-ci sont d’importants catalyseurs de vulcanisation.
Dérivés du soufre quadrivalent
Il existe peu de composés de type SX4 où le soufre soit clairement quadrivalent. En chimie organique, la quadrivalence formelle du soufre se manifeste surtout dans des composés tricoordinés, où l’atome de soufre est lié à trois autres atomes, la quatrième valence étant de type électrostatique (charge positive sur le soufre) ou correspondant à une double liaison possible. Il en est ainsi dans les ions sulfonium R3S+, les sulfoxydes R 漣S(O) 漣R que l’on peut écrire: R 漣 S(=O)R ou R 漣S+(O size=1漣) 漣R, et les ylures de sulfonium [R2S=C(R R )]; les sulfoxydes sont généralement obtenus par oxydation ménagée des sulfures correspondants et les ylures par action d’une base sur les sels de sulfonium.
Dans cette classe de composés, on peut aussi citer les acides sulfiniques R 漣SO 漣OH que l’on obtient par réduction ménagée de chlorures d’acides sulfoniques:
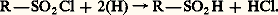
Les sulfinates alcalins traités par un ester de l’acide chloroformique conduisent à un ester sulfinique:

Leur alkylation par un iodure d’alkyle donne une sulfone:

Une propriété physique intéressante des ions sulfonium, des sulfoxydes et des esters sulfiniques est leur stéréo-isomérie optique dès lors que les trois groupes liés au soufre sont différents. Les liaisons du soufre du type sulfonium ne sont pas coplanaires, mais disposées selon les arêtes d’une pyramide à base triangulaire dont l’atome de soufre occupe le sommet (cf. la formule développée ci-après décrivant un ester sulfinique; cette figure montre que les deux structures symétriques par rapport à un plan ne sont pas superposables).
Cette asymétrie, notamment dans le cas des sulfoxydes, est largement mise à profit en synthèse organique pour induire une asymétrie sur un carbone voisin.
Dérivés du soufre hexavalent
On peut faire sur cette hexavalence du soufre les mêmes réserves que sur sa quadrivalence. Il est peu de composés, comme S6 et ses dérivés organiques, où le soufre soit à la fois hexacoordiné et hexavalent, et l’on a, le plus souvent, des dérivés du soufre hexavalent où cet élément est quadricoordiné comme dans l’ion sulfate S2 size=1漣4.
Acides sulfoniques
La classe la plus importante de composés organiques de ce groupe est constituée sans aucun doute par les acides sulfoniques R 漣S3H et leurs dérivés. Comme l’acide sulfurique, ce sont des acides forts, et de nombreux sels d’acides sulfoniques sont solubles dans l’eau. L’introduction de groupes 漣S3H dans les molécules organiques est utilisée dans la préparation des détergents et des composés tensioactifs.
En série aliphatique, les acides sulfoniques sont souvent obtenus par sulfochloruration; celle-ci donne d’abord un chlorure d’acide que l’on hydrolyse ensuite:
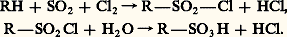
On notera que l’action de réactifs alkylants sur des sulfites alcalins conduit à des esters sulfoniques et non à des esters sulfureux:

En série aromatique, les acides sulfoniques ont une grande importance: le groupe sulfonique est introduit dans la structure de nombreux colorants synthétiques afin d’en faciliter la mise en œuvre, souvent par amélioration de leur solubilité dans l’eau.
Les acides sulfoniques aromatiques sont le plus souvent obtenus par sulfonation des hydrocarbures par l’acide sulfurique concentré, réaction d’ailleurs réversible:

Chlorures d’acides sulfoniques; sulfones ; sulfonamides
Les acides sulfoniques, traités par le pentachlorure de phosphore, donnent des chlorures d’acides sulfoniques, par une réaction analogue à celle qui fournit les chlorures d’acides carboxyliques:

En présence de chlorure d’aluminium (réaction de Friedel et Crafts ), les chlorures d’acides sulfoniques réagissent sur les hydrocarbures aromatiques pour donner des sulfones:

Les sulfones peuvent aussi être obtenues par oxydation des sulfures correspondants, ou (cf. supra ) par alkylation des sels alcalins d’acides sulfiniques.
Une réaction importante des chlorures d’acides sulfoniques est la formation d’amides à partir de l’ammoniac ou des amines primaires ou secondaires:
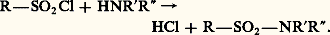
Les «sulfamides» constituent une classe importante de médicaments anti-infectieux. Ils dérivent tous de l’amide sulfanilique:

Composés hétérocycliques sulfurés
Les atomes de soufre ou les groupes 漣SO 漣 ou 漣S2 漣 peuvent être inclus dans des cycles saturés, et les composés ainsi obtenus sont en général tout à fait analogues, sauf dans le cas de petits cycles, aux composés non cycliques correspondants: sulfures, sulfoxydes, sulfones.
Lorsque le soufre est engagé dans des cycles insaturés à caractère aromatique, ceux-ci présentent une stabilité particulière. Quelques exemples d’hétérocycles sulfurés sont donnés dans le tableau ci-après.
Le thiophène (formule 1) accompagne le benzène dans les goudrons de houille. Ses propriétés physiques sont très proches de celles du benzène, et ses propriétés chimiques présentent aussi des analogies avec celles des hydrocarbures aromatiques.
Des systèmes thiophéniques à cycles condensés (exemple: formule 2) se trouvent dans les fractions lourdes des produits pétroliers, et ces composés, ainsi que des systèmes plus condensés, sont, pour une large part, responsables de la teneur en soufre des fuels lourds.
Ces hétérocycles ont été à l’origine de développements récents dans le domaine des composés organiques conducteurs: les polythiophènes, particulièrement ceux qui sont substitués en position 3 (formule 4), dopés par des donneurs d’électrons (iode, chlorure ferrique, etc.) sont conducteurs de l’électricité (exemple d’application envisagée: accumulateurs), et les dérivés du tétrathiafulvalène (TTF, formule 3) forment des complexes à transfert de charge (exemple: TTF-tétracyanoquinodiméthane) et des sels ions radicaux [exemple: (TTF)+ 練 X size=1漣] qui présentent des propriétés électriques anisotropes; à très basse température, certains d’entre eux sont des supraconducteurs organiques.
Le soufre existe aussi dans des composés hétérocycliques sulfurés et azotés. Le noyau du thiazole (formule 5) a une grande importance biologique. On le trouve, sous forme d’ion positif, dans la vitamine B1, ou thiamine. On le rencontre aussi, sous forme hydrogénée, dans les pénicillines.
Enfin, le noyau de la phénothiazine (formule 6) intervient dans la structure de médicaments tranquillisants.
La chimie organique du soufre connaît un développement constant lié à l’utilisation des composés sulfurés comme intermédiaires de synthèse en chimie fine et industrielle (un exemple frappant: l’utilisation des sulfones dans la synthèse industrielle de la vitamine A).
3. Métabolisme
Après une rapide étude du cycle biologique du soufre, on examinera successivement les aspects essentiels du métabolisme du soufre, à savoir: l’oxydation des sulfures en sulfates dans la nature, chez certains micro-organismes présentant des caractères particuliers, et, d’une manière plus générale, chez les êtres vivants; la réduction des sulfates et leur utilisation tout spécialement par certains micro-organismes dotés de propriétés spécifiques; la biosynthèse des acides aminés soufrés et de leurs dérivés par les micro-organismes et les plantes; enfin, la dégradation des acides aminés soufrés et de leurs dérivés par les différents organismes vivants.
Le «cycle» du soufre
La notion de «cycle» du soufre dans la nature et la matière vivante, dégagée depuis fort longtemps, est justifiée par de multiples observations qu’il est possible de résumer de la façon suivante: les formes minérales réduites du soufre, les sulfures, subissent des oxydations chimiques et enzymatiques qui les transforment en soufre élémentaire et en sulfates; réciproquement, une réduction des sulfates, faisant intervenir divers intermédiaires, en particulier le sulfite et le thiosulfate, a lieu. De plus, les micro-organismes et les plantes synthétisent, à partir des formes minérales du soufre, un certain nombre de composés organiques nécessaires à leur vie, ou à celle d’autres organismes, principalement les animaux qui doivent obligatoirement trouver dans leur alimentation différents composés organiques soufrés qu’ils utilisent, transforment et dégradent en produits d’élimination.
Certaines étapes indiquées sur la figure 4 sont chimiques; d’autres sont catalysées par des systèmes enzymatiques.
Oxydation des sulfures en sulfates
L’oxydation chimique des sulfures soit naturels, soit produits par l’utilisation domestique ou industrielle de divers combustibles (charbon, gaz, dérivés du pétrole) a lieu essentiellement dans l’atmosphère (fig. 5 a). C’est une transformation lente mais dont l’importance est considérable. Les sulfates ainsi formés sont entraînés par les pluies et répandus sur les sols des continents, dans les fleuves et les océans. W. Kellog et ses collaborateurs (1972) ont décrit le «déséquilibre» des composés soufrés du système atmosphère-océans provoqué par les activités humaines, et tout particulièrement les combustions. Ces auteurs indiquent, en effet, que la production mondiale de sulfates, due aux combustions de charbon et de «fuels», atteint 150 millions de tonnes par an, dont 93,5 p. 100 proviennent de l’hémisphère Nord, tandis que seulement 6,5 p. 100 sont fournis par l’hémisphère Sud, et ils soulignent l’importance de ces phénomènes en relation avec les problèmes de pollution.
L’oxydation enzymatique des sulfures en sulfates est effectuée par les sulfobactéries autotrophes. Ces phénomènes d’oxydation présentent pour ces organismes une importance particulière, puisqu’ils leur fournissent la majeure partie de l’énergie nécessaire à leur croissance (H. Peck, 1962). Le mécanisme de l’oxydation du sulfite en sulfate a été bien élucidé par H. Peck et ses collaborateurs qui ont montré, en 1965, qu’au cours de cette oxydation il y a formation, à partir de sulfite et d’adénosine 5’-monophosphate (AMP), d’adénosine 5’-phosphosulfate (APS) riche en énergie (fig. 5 b).
Enfin, chez les plantes, les micro-organismes et les animaux, l’oxydation, en grande partie enzymatique, des sulfures en sulfates constitue un phénomène de détoxication et d’élimination de l’hydrogène sulfuré provenant de la désulfhydration de la cystéine et de l’homocystéine.
Réduction des sulfates et leur utilisation
À l’exception de l’incorporation directe des sulfates dans des molécules organiques pour la formation des esters sulfuriques, l’utilisation des sulfates nécessite leur réduction préalable en sulfites, et leur «activation» par des enzymes qui consomment de l’ATP (fig. 6 a). Il s’agit alors du métabolisme «assimilatoire» existant en particulier dans la levure.
Chez les animaux supérieurs, la réduction du sulfate n’a pratiquement pas lieu; en revanche, les plantes supérieures transforment le sulfate en méthionine et cystéine. Enfin, les bactéries sulfatoréductrices réduisent les formes oxydées du soufre minéral en sulfures (fig. 6 b). Ces phénomènes sont fort importants, puisque les formes oxydées du soufre minéral sont pour ces organismes d’indispensables accepteurs d’électrons.
Biosynthèse des acides aminés soufrés
Les animaux supérieurs sont incapables de synthétiser la méthionine , qui est considérée de ce fait comme un acide aminé indispensable. En effet, elle est nécessaire, d’une part, à la biosynthèse de nombreuses protéines; d’autre part, elle est la source des groupements méthyle pour les processus de transméthylations. Les animaux doivent donc trouver dans leur alimentation la méthionine elle-même, ou l’un de ses précurseurs.
En revanche, les plantes et les micro-organismes effectuent la biosynthèse de cet acide aminé (fig. 7). Cette biosynthèse a lieu, chez un micro-organisme, Salmonella typhimurium , à partir de méthylmercaptan et d’O-succinylhomosérine (M. Flavin et C. Slaughter, 1967), tandis que, chez les champignons, elle nécessite la présence d’acétylhomosérine (D. Moore et J. Thompson, 1967).
Les bactéries et les tissus animaux synthétisent également la méthionine par transméthylation de l’homocystéine.
L’homocystéine est formée par les plantes et diverses bactéries à partir de dérivés de l’homosérine et de sulfure. Chez Salmonella typhi-murium , ainsi que dans diverses souches de Escherichia coli , elle est également produite par dégradation de la cystathionine, synthétisée elle-même à partir de cystéine et d’O-succinylhomosérine (fig. 7).
Chez les plantes, les micro-organismes et dans les tissus animaux, la cystéine résulte d’une condensation entre l’hydrogène sulfuré et la sérine, ou un de ses dérivés (fig. 7). Cependant, chez les animaux, la majeure partie de la cystéine provient de l’alimentation, ou de la dégradation de la méthionine (fig. 8).
Dégradation des acides soufrés et de leurs dérivés
Chez les animaux, la première étape de la dégradation de la méthionine est son activation sous forme de S-adénosylméthionine, qui donne naissance à l’homocystéine (fig. 8). Celle-ci est alors transformée en cystathionine par une réaction de condensation avec la sérine. Cette réaction, catalysée par une enzyme nécessitant le phosphate de pyridoxal comme coenzyme, n’a pas lieu lorsque l’organisme est atteint d’une maladie métabolique, l’homocystinurie , généralement associée à de graves désordres mentaux; il y a alors accumulation d’homocystéine et d’homocystine dans l’organisme affecté.
La cystathionine est ensuite dégradée en cystéine par une enzyme nécessitant également le phosphate de pyridoxal comme coenzyme. Le défaut de la dégradation de la cystathionine, et donc l’accumulation de cet acide aminé, est observé dans une maladie métabolique, la cystathioninurie , qui est, elle aussi, généralement associée à de profonds troubles mentaux.
La cystéine est soit désulfhydrée, ce qui libère de l’hydrogène sulfuré, soit oxydée en acide cystéine sulfinique, qui subit deux réactions essentielles: une décarboxylation qui conduit à l’hypotaurine, puis à la taurine, l’une des formes d’élimination du soufre, mais aussi substance dont l’importance physiologique semble non négligeable (J. Jacobsen et L. Smith, 1968); une désamination entraînant une production de sulfite, qui est ensuite oxydé en sulfate.
Chez les plantes supérieures, les informations sur la dégradation des acides aminés soufrés sont jusqu’ici très fragmentaires. Il faut d’ailleurs signaler que les plantes contiennent un nombre important de composés soufrés qui leur sont spécifiques, mais dont on connaît mal le rôle, et dont on ignore en général les mécanismes de biosynthèse. En revanche, de nombreuses études ont été faites chez les levures, les champignons et les bactéries.
Il n’est pas sans intérêt de remarquer que les phénomènes de transsulfuration – c’est-à-dire le transfert du soufre entre un acide aminé à trois atomes de carbone, la cystéine, et un acide aminé à quatre atomes de carbone, l’homocystéine – sont, en quelque sorte, inverses selon qu’il s’agit des animaux ou des micro-organismes (bactéries, champignons et levures). Dans les deux cas, la cystathionine intervient: chez les animaux, elle est synthétisée à partir d’homocystéine et de sérine, et sa dégradation aboutit à la cystéine; tandis que, chez les micro-organismes, la cystathionine est synthétisée à partir de la cystéine et d’un dérivé de l’homosérine, et sa dégradation donne naissance à l’homocystéine.
Chez les animaux et chez les micro-organismes, la plupart des enzymes impliquées dans ces phénomènes de biosynthèse et de dégradation ont été bien étudiées, et leurs propriétés sont en grande partie connues. Il s’agit, dans de très nombreux cas, d’enzymes nécessitant le phosphate de pyridoxal comme coenzyme.
La régulation de la biosynthèse et de l’activité de ces enzymes a fait l’objet d’études détaillées (N. Kredich, 1971). Chez les micro-organismes, la méthionine réprime la plupart des enzymes participant à la biosynthèse de cet acide aminé; chez les animaux, les teneurs en protéines et en pyridoxine des régimes ont une influence sur le taux des enzymes du métabolisme des acides aminés soufrés présents dans divers organes. Enfin, certaines hormones, telles que la thyroxine et l’hydrocortisone, modifient le taux de plusieurs de ces enzymes dans les tissus animaux.
soufre [ sufr ] n. m.
• 1270; sulfre 1120; lat. sulfur
1 ♦ Anciennt L'un des trois principes actifs de l'ancienne chimie, considéré comme une condensation de la matière du feu.
2 ♦ Mod. Élément (S; no at. 16; m. at. 32,06) du même groupe que l'oxygène, le sélénium, le tellure. Soufre naturel, en cristaux orthorhombiques jaunes. Soufre amorphe, jaune citron, pulvérulent, extrait des sels de soufre. ⇒ sulfate, sulfure. Fleur de soufre, obtenue par condensation brusque des vapeurs de soufre. — Pharm. Lait de soufre : sol colloïdal obtenu par action d'un acide sur une solution d'hyposulfite.
♢ Loc. Sentir le soufre : être peu orthodoxe, sembler inspiré par le diable. Écrits, propos qui sentent le soufre. ⇒ sulfureux.
3 ♦ Couleur d'un jaune clair semblable à celle du soufre. — Appos. Jaune soufre. ⇒ soufré.
● soufre nom masculin (latin sulfur) Corps simple solide, non métallique, d'une couleur jaune citron. (Élément chimique de symbole S.) Numéro atomique : 16 Masse atomique : 32,06 Masse volumique : 1,56 g°cm3 Température de fusion : 112,8 °C ● soufre (difficultés) nom masculin (latin sulfur) Orthographe Soufre et les mots de la même famille ne prennent qu'un seul f : soufrer, soufrage. ● soufre (expressions) nom masculin (latin sulfur) Fleur de soufre ou soufre sublimé, soufre obtenu par refroidissement brusque de sa vapeur. Goût de soufre, goût désagréable des vins qui ont été sulfités en excès. Sentir le soufre, présenter un caractère d'hérésie. ● soufre (homonymes) nom masculin (latin sulfur) souffre forme conjuguée du verbe souffrir souffrent forme conjuguée du verbe souffrir souffres forme conjuguée du verbe souffrir ● soufre adjectif invariable De la couleur jaune clair du soufre. ● soufre (homonymes) adjectif invariable souffre forme conjuguée du verbe souffrir souffrent forme conjuguée du verbe souffrir souffres forme conjuguée du verbe souffrir
soufre
n. m. et adj. inv.
d1./d élément non métallique (symbole S) de numéro atomique Z = 16.
— Solide (S 8) jaune et cassant.
|| Fleur de soufre: soufre pulvérulent.
|| adj. inv. De la couleur jaune clair du soufre.
d2./d Loc. fig. Sentir le soufre: avoir qqch de diabolique.
Encycl. Le soufre est employé pour la vulcanisation du caoutchouc. Sous forme combinée (acide sulfurique, sulfates, sulfures, etc.), ses utilisations sont nombreuses. C'est aussi un constituant de certaines protéines.
⇒SOUFRE, subst. masc.
A. — 1. CHIM. Métalloïde solide (symb. S, n ° atomique 16) friable, de couleur jaune, sans saveur ni odeur, qui fond facilement, brûle avec une flamme bleue en exhalant des vapeurs suffocantes (gaz sulfureux), qui est répandu dans la nature à l'état libre ou combiné sous forme de sulfures, de sulfates. Atome, molécule de soufre; isotopes stables, radioactifs du soufre; soufre natif, libre; soufre solide, fondu, liquide, gazeux; vapeurs de soufre; gisement de soufre; minerais de soufre; exploitation, raffinage du soufre; soufre des fluides hydrothermaux; composés, combinaisons du soufre. Je suis monté au haut de Vésuve (...). Le cratère est curieux. Le soufre a poussé sur ses bords en formidables végétations jaune et lie de vin (FLAUB., Corresp., 1851, p. 306). Par les actions météoriques, le soufre passe facilement à l'état de sulfates solubles. Transporté ainsi par les eaux de l'océan, il prend une part importante dans l'ensemble des sels de l'eau de mer. Il se concentre dans les lagunes d'évaporation sous forme de gypse (Géol., t. 1, 1972, pp. 971-972 [Encyclop. de la Pléiade]).
— [Avec déterm. ou en loc. pour désigner]
♦ [des variétés allotropiques de ce corps] Soufres cristallisés, amorphes.
Soufre orthorhombique, octaédrique. Soufre orthorhombique (...) il se présente sous forme d'octaèdres jaune clair appartenant au système orthorhombique. Il est stable à la température ordinaire. Il fond à 115 o (R. QUELET, Précis de chim., Paris, P.U.F., t. 2, 1964, p. 177).
Soufre monoclinique, clinorhombique, prismatique, aciculaire. Soufre clinorhombique (...) il se présente sous forme d'aiguilles prismatiques (...). Il n'est stable qu'au-dessus de 95 o et se transforme lentement en soufre octaédrique à la température ordinaire (R. QUELET, Précis de chim., Paris, P.U.F., t. 2, 1964, p. 177).
Soufre mou. Variété amorphe de soufre. En chauffant [le soufre] jusque vers 230 o afin d'obtenir un liquide à nouveau fluide, on obtient un ruban brun mou doué d'une élasticité comparable à celle du caoutchouc: c'est le soufre mou (...), variété peu stable (R. QUELET, Précis de chim., Paris, P.U.F., t. 2, 1964, p. 178).
♦ [des variétés comm.] Soufre en canon. V. canon1 A 2 b.
Fleur de soufre. Variété pulvérulente de soufre naturel ou sublimé après raffinage; mélange de soufre orthorhombique et de soufre amorphe. La solfatare del Vomero (...) flambe et gronde et lâche des bouffées de vapeur entre deux éruptions du Vésuve (...), la fleur de soufre maculant les fleurs des orangers et les grappes et la pampre dans les jardinets (CENDRARS, Bourlinguer, 1948, p. 25).
Soufre lavé. Soufre sublimé lavé à l'eau pour le débarrasser de l'acide sulfurique (d'apr. DUVAL 1959). Cachets laxatifs (...) de la formule suivante: soufre lavé 0,25 g, poudre de séné 0,15 g, rhubarbe 0,20 g (Cl. DUVAL, Le Soufre, 1967, p. 114).
Soufre précipité ou, vx, magistère de soufre. Soufre officinal se présentant sous la forme d'une poudre très fine, presque blanche ou jaune pâle, réservé en général à l'usage interne (d'apr. Méd. Biol. t. 3 1972).
Soufre sublimé. Soufre obtenu lors du raffinage par refroidissement brusque de la vapeur de soufre, se présentant sous la forme de poudre jaune citron, réservé à l'usage externe (d'apr. Méd. Biol. t. 3 1972).
Soufre trituré. Les usines préparent aussi du soufre trituré par martelage et blutage des canons. On fait aussi du trituré ventilé en réalisant, grâce à un courant d'air, une classification granulométrique du précédent (Cl. DUVAL, Le Soufre, 1967, p. 16).
Soufre mouillable. ,,Soufre à 97 % contenant un peu de dextrine et de fiel de bœuf et adhérant bien aux feuilles de vigne par temps humide`` (DUVAL 1959). On s'est donc efforcé (...) de mettre au point des produits plus adéquats ou d'un emploi plus facile (...): soufres mouillables, fongicides et insecticides de synthèse (LEVADOUX, Vigne, 1961, p. 80).
Soufre insecticide. ,,Soufre additionné de nicotine ou de roténone`` (DUVAL 1959).
♦ [des composés du soufre]
Bichlorure de soufre. Liquide rouge grenat de formule SCl2. Le bichlorure Cl-S-Cl (...) agit comme chlorurant et sulfurant; il sert également d'agent de vulcanisation (Cl. DUVAL, Le Soufre, 1967, p. 45).
Chlorure, monochlorure de soufre. Liquide huileux, jaune orangé de formule S2 Cl2 [Cl-S-S-Cl] (d'apr. Méd. Biol. t. 3 1972). Le chlorure de soufre fume à l'air, attaque les muqueuses, sent très mauvais (...). C'est un agent de chloruration commode (...); il sert aussi à préparer le tétrachlorure de carbone et à vulcaniser le caoutchouc (Cl. DUVAL, Le Soufre, 1967, pp. 44-45).
Soufre doré (d'antimoine). V. doré II B 1 a ex. de Graffigny.
2. BIOCHIM. [Ce corps ou l'un de ses composés dans les milieux biologiques] Besoins des plantes en soufre; légumes riches en soufre. [Les cellules vivantes] trouvent aussi dans le plasma sanguin l'azote, le soufre, et le phosphore, dont elles se servent pour la construction de nouvelles cellules, et pour la croissance et la réparation des organes (CARREL, L'Homme, 1935, p. 93).
♦ Cycle du soufre. Les déchets organiques sont décomposés par des bactéries hétérotrophes qui libèrent l'hydrogène sulfuré en utilisant les sulfates comme source d'énergie à la place de l'oxygène. À l'inverse d'autres bactéries réoxydent l'hydrogène sulfuré en sulfates, rendant le soufre disponible aux autres êtres vivants. C'est le cycle du soufre (FRIEDEL 1980).
3. [Ce corps ou l'un de ses composés envisagé dans ses usages]
— [Autrefois, comme moyen de défense] Vos pères, toujours fiers, jamais diminués (...), N'avaient besoin, pour prendre un château rude et fort, Que d'une échelle en bois, pliant sous leur effort, Dressée au pied des murs d'où ruisselait le soufre (HUGO, Burgr., 1843, p. 85).
— Domaine des arts. Un homme (...) déposa par terre une couronne de sel gemme, ornée de dessins hiératiques faits avec du soufre et des losanges de nacre (FLAUB., Salammbô, t. 2, 1863, p. 148). Les humanistes du XVIe siècle échangeaient en Italie des moulages en soufre de monnaies antiques rares (L'Hist. et ses méth., 1961, p. 436).
— TECHNOL. [Servant à préparer diverses substances, matériaux ou objets] Scellement au soufre (fondu); tannage au soufre; colorants au soufre. Procurez-nous du fer pour les canons, de l'acier pour les batteries, du salpêtre, du charbon et du soufre pour la poudre (VERNE, Île myst., 1874, p. 130). Élément de base de l'industrie chimique, le soufre est employé dans l'industrie du papier, du caoutchouc, des colorants, utilisé dans la fabrication des insecticides, des allumettes, des feux d'artifice (SCHUBNEL 1981).
— PHARM., MÉD. Baume de soufre; lotion, pommade, savon au soufre; tablette de soufre; usage interne, externe du soufre; fumigation de soufre. Elle me soignait à sa manière, et, au sortir du bain, elle m'enduisait de soufre de la tête aux pieds, puis elle me faisait avaler des boulettes de soufre pulvérisé dans du beurre et du sucre (SAND, Hist. vie, t. 2, 1855, p. 215). La croissance, une rougeole, m'avaient anémiée; je prenais des bains de soufre, des fortifiants (BEAUVOIR, Mém. j. fille, 1958, p. 34).
— [En agric.] Pulvérisation de soufre; traitement au soufre. L'action du soufre sur l'oïdium est « curative » en ce sens que par l'action de ses émanations il détruit le mycélium de l'uncinula (LEVADOUX, Vigne, 1961, p. 74).
— [Comme désinfectant] Ce n'est pas une maison bien avenante, j'en conviens. (...) on blanchira à la chaux toutes les pièces, puis on fera brûler du soufre (BOSCO, Mas Théot., 1945, p. 212).
4. [P. réf. à certaines caractéristiques du soufre ou de quelques-uns de ses composés]
— (Odeur de) soufre. Odeur de l'hydrogène sulfuré ou de l'anhydride sulfureux (formé par la combustion du soufre) ou, p. ext., d'autres corps à odeur forte. Sentir le soufre. Dans la fumée qui piqua les yeux encore pendant longtemps, l'odeur pointue de la poudre et du soufre nous restait comme pour tuer les punaises et les puces de la terre entière (CÉLINE, Voyage, 1932, p. 23). C'est le seul endroit, où on brûlait un peu de charbon, le si gras, le si coulant (...), qui sent l'asphalte. C'est agréable comme odeur, mais c'est son relent de soufre qui pique quand même un petit peu fort! (CÉLINE, Mort à crédit, 1936, p. 277).
— Goût de soufre. Goût lié à l'emploi de l'anhydride sulfureux. Il importe de ne jamais sulfiter à l'excès [un moût ou un vin], erreur qui donnerait au vin une odeur désagréable, un goût de soufre (LICH. Vins 1984, s.v. sulfurisation).
— [P. réf. à la couleur] En empl. subst., dans des loc. adj. ou comme adj. inv.
(Couleur, jaune) (de) soufre. Jaune comme le soufre naturel. Trois gilets, l'un couleur soufre (BALZAC, Illus. perdues, 1843, p. 671). Des murailles aux arêtes couvertes de mousses vert émeraude et de lichens soufre (HUYSMANS, Oblat, t. 1, 1903, p. 77). Fauteuils de tapisserie bas et profonds, semés de coussins d'un jaune de soufre tellement éclatant qu'il en émanait une sorte de phosphorescence (GRACQ, Argol, 1938, p. 27).
Var. (Jaune) fleur de soufre. Le jaune fleur de soufre aimé de Véronèse (BANVILLE, Cariat., 1842, p. 206). Une collection d'habits du XVIIIe siècle, habits fleurs de soufre, gorge de pigeon, pluie de roses, fleur de pêcher (GONCOURT, Ch. Demailly, 1860, p. 144).
(Couleur de) flamme de soufre. Bleu comme la flamme du soufre qui brûle. Un grand cabinet (...) était, jusqu'au plafond même, matelassé d'un satin flamme de soufre (BOURGES, Crépusc. dieux, 1884, p. 121). Des pays où les fleurs sont larges comme des cloches, les flots couleur de flamme de soufre (JAMMES, Mém., 1921, p. 163).
♦ P. anal. Soufre végétal. ,,Il est constitué par les spores de lycopode (...). C'est une poudre jaune formée de grains de 30  de diamètre (...). Le soufre végétal sert à faire des suppositoires, des flammes éclairs, des pièces d'artifice`` (Cl. DUVAL, op. cit., p. 108).
de diamètre (...). Le soufre végétal sert à faire des suppositoires, des flammes éclairs, des pièces d'artifice`` (Cl. DUVAL, op. cit., p. 108).
 de diamètre (...). Le soufre végétal sert à faire des suppositoires, des flammes éclairs, des pièces d'artifice`` (Cl. DUVAL, op. cit., p. 108).
de diamètre (...). Le soufre végétal sert à faire des suppositoires, des flammes éclairs, des pièces d'artifice`` (Cl. DUVAL, op. cit., p. 108).B. — [P. réf. à la Bible, à certaines croyances relig. où le soufre, en tant que matière inflammable, intervient dans le châtiment des impies]
1. [P. réf. aux pluies, aux torrents de soufre envoyés par Dieu (Gen. 19, 24; Deut. 29, 22; Is. 30, 33; Éz. 38, 22)] Voilà, chère Comtesse nos mœurs modernes (...). Pour moi, je ne serais pas surpris qu'une pluie de soufre et de feu nous tombât sur le dos, un de ces jours (MÉRIMÉE, Lettres ctesse de Montijo, t. 1, 1847, p. 285). Vous qui êtes pleine de grâces (...), faites des lieux où ils prétendent vous vénérer, Lourdes et autres, des lieux de catastrophe et de ruine. (...) laissez le Christ vengeur répandre sur eux son soufre et sa poix (GIRAUDOUX, Siegfried et Lim., 1922, p. 166).
2. [P. réf. à l'enfer représenté comme un étang de soufre enflammé (Apoc. 14, 10; 19, 20; 20, 9)] Il y a aussi des hommes qui ne peuvent être bien qu'au milieu des hommes contens (...). Ceux-là tâchent de bien faire sans croire beaucoup à l'étang de soufre (SENANCOUR, Obermann, t. 1, 1840, p. 190):
• Le Mauvais brûlera vos âmes, dans son gouffre,
Sur des lits ruisselants de résine et de soufre;
Vous vous tordrez, rongés d'un feu toujours accru,
Aux rires des Démons en qui vous aurez cru
LECONTE DE LISLE, Poèmes barb., 1878, p. 130.
— Au fig., littér. [Symb. de douleur, de tourment] Dieu! n'être pas aimé, c'est là la nudité! Être maudit, c'est là le bitume et le soufre (HUGO, Fin Satan, 1885, p. 905). La crise manquée d'hier soir est encore trop proche (...) pour lui permettre [à son père] de cracher le soufre, de me jeter à la tête les arguments d'une logique d'enfer (H. BAZIN, Huile sur feu, 1954, p. 281).
— [Le soufre intervenant dans le supplice des sorciers, des hérétiques] Chemise de soufre. Vos martyrs de l'Île du Sud (...) qu'on crucifiait et qu'on arrosait avec du soufre liquide (CLAUDEL, Soulier, 1929, 4e journée, 2, p. 858).
3. [P. réf. aux vapeurs sulfureuses, à l'odeur de soufre censées accompagner les manifestations du diable, des démons] Ce démon qui marche devant nous, sans pourtant laisser derrière lui l'odeur du soufre, (...) ce Han d'Islande qui voit à travers les murs (HUGO, Han d'Isl., 1823, p. 404). Quoiqu'il n'eût ni queue, Ni cornes, ni pied-bot, — quoiqu'il ne sentît pas Le soufre ou le bitume, à son regard oblique, À sa lèvre que crispe un rire sardonique, À son geste anguleux, à sa voix, à son pas, Tout homme un peu prudent aurait couru bien vite À sa Bible et vous l'eût aspergé d'eau bénite (GAUTIER, Albertus, 1833, p. 164).
— Au fig.
♦ [À propos d'une pers., d'une chose qui a qqc. de diabolique, qui paraît peu orthodoxe; surtout dans la loc. sentir le soufre] Pourquoi leur nom n'est-il inscrit nulle part sur les pierres qu'ils ont relevées (...)? Qu'est-ce que cette vapeur de soufre et cette odeur de damnation, aujourd'hui répandues sur ces trois figures qui furent un moment bénies? (BARRÈS, Colline insp., 1913, p. 83). Il y a aussi le Verlaine second, qui sent le soufre et autre chose, le poète maudit, le fauve déchaîné (Le Temps, 20 sept. 1938).
♦ [P. réf. à certains caractères du diable]
[Comme symb. du mal] Je mourrai promptement, allez, si je perds cet enfant (...). Elle eut des larmes dans les yeux, et s'arrêta. Cette sensibilité chez cette fille de soufre et de feu fit frissonner Mme Marneffe (BALZAC, Cous. Bette, 1846, p. 98).
[P. réf. à un pouvoir surnaturel] Si notre vie manque de soufre, c'est-à-dire d'une constante magie, c'est qu'il nous plaît de regarder nos actes et de nous perdre en considérations sur les formes rêvées de nos actes, au lieu d'être poussés par eux (ARTAUD, Théâtre et son double, 1938, p. 13).
C. — ALCHIM. Matière inflammable; principe actif des alchimistes qui agit sur le mercure inerte et qui correspond au feu, au soleil, au principe masculin. [Le soufre et l'arsenic] mots sous lesquels on confondait à la fois les sulfures métalliques, divers corps inflammables congénères, et les matières quintessenciées que les philosophes prétendaient en tirer. C'est dans ce sens que les métaux ont été regardés au temps des Arabes, comme composés de soufre et de mercure (BERTHELOT, Orig. alchim., 1885, p. 280). Le soufre et le mercure, le fixe et le volatil s'affrontent avant la conjonction finale (...). Lorsqu'un homme, le soufre, et une femme, le mercure, sont représentés enfermés dans un sépulcre, ils représentent ces deux matières au sein de l'œuf philosophique (CARON, HUTIN, Alchimistes, 1959, p. 141).
REM. Soufrante, subst. fém., arg. Allumette. Des vociférations se heurtaient: « Enfant de salaud qui a éteint la camoufle!... Fantassin de malheur!... Les soufrantes au clair, ceux qui en ont! » (COURTELINE, Gaîtés esc., Potiron, 1890, IV, p. 234).
Prononc. et Orth.:[ ]. Att. ds Ac. dep. 1694. Étymol. et Hist. 1. a) 1re moit. du XIIe s. sulfre « corps simple de couleur jaune, qui exhale en brûlant une odeur suffocante » (Psautier Cambridge, 10, 7 ds T.-L.); ca 1125-50 soufre (Grand mal fist Adam, éd. H. Suchier, 97); ca 1150 soffre (Charroi Nymes, éd. D. McMillan, 1148); b) 1358-59 sufrevy « soufre vif, soufre naturel » (doc. ds GDF. Compl., s.v. vif); 1679 soufre d'antimoine (RICH.); 1690 fleurs de soufre, lait de soufre (FUR.); 1762 foie de soufre (Ac., s.v. foie); 2. 1742 couleur de souphre (LESSER, Théologie des insectes, 131 ds QUEM. DDL t. 20); 3. 1782 « empreinte que l'on prend sur des tablettes de soufre » (Mme DE GENLIS, Adèle et Théodore, 2e éd., p. 85). Du lat. sulphur, forme grécisée de sulpur, d'où l'a. lyonn. sopre (fin XIIIe-déb. XIVe s., Li Purgatoires de saint Patrice, B.N. 423, f ° 37c ds GDF. Compl.), et l'a. prov. solpre (RAYN.; LEVY Prov.). Sulpur est en outre conservé dans les parlers des Alpes fr. et du Massif Central (v. FEW t. 12, p. 420a). Fréq. abs. littér.:301. Fréq. rel. littér.:XIXe s.: a) 353, b) 706; XXe s.: a) 417, b) 348.
]. Att. ds Ac. dep. 1694. Étymol. et Hist. 1. a) 1re moit. du XIIe s. sulfre « corps simple de couleur jaune, qui exhale en brûlant une odeur suffocante » (Psautier Cambridge, 10, 7 ds T.-L.); ca 1125-50 soufre (Grand mal fist Adam, éd. H. Suchier, 97); ca 1150 soffre (Charroi Nymes, éd. D. McMillan, 1148); b) 1358-59 sufrevy « soufre vif, soufre naturel » (doc. ds GDF. Compl., s.v. vif); 1679 soufre d'antimoine (RICH.); 1690 fleurs de soufre, lait de soufre (FUR.); 1762 foie de soufre (Ac., s.v. foie); 2. 1742 couleur de souphre (LESSER, Théologie des insectes, 131 ds QUEM. DDL t. 20); 3. 1782 « empreinte que l'on prend sur des tablettes de soufre » (Mme DE GENLIS, Adèle et Théodore, 2e éd., p. 85). Du lat. sulphur, forme grécisée de sulpur, d'où l'a. lyonn. sopre (fin XIIIe-déb. XIVe s., Li Purgatoires de saint Patrice, B.N. 423, f ° 37c ds GDF. Compl.), et l'a. prov. solpre (RAYN.; LEVY Prov.). Sulpur est en outre conservé dans les parlers des Alpes fr. et du Massif Central (v. FEW t. 12, p. 420a). Fréq. abs. littér.:301. Fréq. rel. littér.:XIXe s.: a) 353, b) 706; XXe s.: a) 417, b) 348.
 ]. Att. ds Ac. dep. 1694. Étymol. et Hist. 1. a) 1re moit. du XIIe s. sulfre « corps simple de couleur jaune, qui exhale en brûlant une odeur suffocante » (Psautier Cambridge, 10, 7 ds T.-L.); ca 1125-50 soufre (Grand mal fist Adam, éd. H. Suchier, 97); ca 1150 soffre (Charroi Nymes, éd. D. McMillan, 1148); b) 1358-59 sufrevy « soufre vif, soufre naturel » (doc. ds GDF. Compl., s.v. vif); 1679 soufre d'antimoine (RICH.); 1690 fleurs de soufre, lait de soufre (FUR.); 1762 foie de soufre (Ac., s.v. foie); 2. 1742 couleur de souphre (LESSER, Théologie des insectes, 131 ds QUEM. DDL t. 20); 3. 1782 « empreinte que l'on prend sur des tablettes de soufre » (Mme DE GENLIS, Adèle et Théodore, 2e éd., p. 85). Du lat. sulphur, forme grécisée de sulpur, d'où l'a. lyonn. sopre (fin XIIIe-déb. XIVe s., Li Purgatoires de saint Patrice, B.N. 423, f ° 37c ds GDF. Compl.), et l'a. prov. solpre (RAYN.; LEVY Prov.). Sulpur est en outre conservé dans les parlers des Alpes fr. et du Massif Central (v. FEW t. 12, p. 420a). Fréq. abs. littér.:301. Fréq. rel. littér.:XIXe s.: a) 353, b) 706; XXe s.: a) 417, b) 348.
]. Att. ds Ac. dep. 1694. Étymol. et Hist. 1. a) 1re moit. du XIIe s. sulfre « corps simple de couleur jaune, qui exhale en brûlant une odeur suffocante » (Psautier Cambridge, 10, 7 ds T.-L.); ca 1125-50 soufre (Grand mal fist Adam, éd. H. Suchier, 97); ca 1150 soffre (Charroi Nymes, éd. D. McMillan, 1148); b) 1358-59 sufrevy « soufre vif, soufre naturel » (doc. ds GDF. Compl., s.v. vif); 1679 soufre d'antimoine (RICH.); 1690 fleurs de soufre, lait de soufre (FUR.); 1762 foie de soufre (Ac., s.v. foie); 2. 1742 couleur de souphre (LESSER, Théologie des insectes, 131 ds QUEM. DDL t. 20); 3. 1782 « empreinte que l'on prend sur des tablettes de soufre » (Mme DE GENLIS, Adèle et Théodore, 2e éd., p. 85). Du lat. sulphur, forme grécisée de sulpur, d'où l'a. lyonn. sopre (fin XIIIe-déb. XIVe s., Li Purgatoires de saint Patrice, B.N. 423, f ° 37c ds GDF. Compl.), et l'a. prov. solpre (RAYN.; LEVY Prov.). Sulpur est en outre conservé dans les parlers des Alpes fr. et du Massif Central (v. FEW t. 12, p. 420a). Fréq. abs. littér.:301. Fréq. rel. littér.:XIXe s.: a) 353, b) 706; XXe s.: a) 417, b) 348.DÉR. Soufreux, -euse, adj. a) Qui a rapport au soufre, qui en contient, a une odeur de soufre. Une grande fumée, droite et vive, avec des bouffées soufreuses (LA VARENDE, Heur. humbles, La Phoebé, 1942, p. 163). Et lorsque j'eus atteint cet âge respectable (...) repris par mes parents, je m'assis à leur table héritier, fils et roi d'un domaine excessif où de très déchus anges (...) et des démons soufreux jetaient dans les vidanges des oiseaux empaillés (QUENEAU, Si tu t'imagines, 1952, p. 12). b) Qui a la couleur jaune du soufre. De grandes loques de ciel mauve pâlirent sur l'horizon des champs, assombris davantage, sous le mauve monotone de la nuée, par une mince ligne de clarté soufreuse (GENEVOIX, Raboliot, 1925, p. 166). — [ ], fém. [-ø:z]. — 1re attest. 1549 « qui contient du soufre, qui répand une odeur de soufre » (EST.); de soufre, suff. -eux.
], fém. [-ø:z]. — 1re attest. 1549 « qui contient du soufre, qui répand une odeur de soufre » (EST.); de soufre, suff. -eux.
 ], fém. [-ø:z]. — 1re attest. 1549 « qui contient du soufre, qui répand une odeur de soufre » (EST.); de soufre, suff. -eux.
], fém. [-ø:z]. — 1re attest. 1549 « qui contient du soufre, qui répand une odeur de soufre » (EST.); de soufre, suff. -eux.BBG. — GOHIN 1903, p. 377. — QUEM. DDL t. 16, 20.
soufre [sufʀ] n. m.
ÉTYM. V. 1265; sulfre, v. 1120; lat. sulfur, sulfuris.
❖
1 Anciennt. L'un des trois principes actifs de l'ancienne chimie, « substance homogène, liquide, oléagineuse, visqueuse et inflammable, qui monte (…) en forme d'huile après l'esprit dans la distillation qui se tire de tous les corps » (Furetière, 1690). || Soufre des philosophes, ou « père des métaux ». || Soufre d'antimoine. || Fleur de soufre. — (1690). Par anal. || Foie de soufre : sulfure de potasse des pharmacopées (trisulfure de potassium). — Lait de soufre : sol colloïdal obtenu par action d'un acide sur une solution d'hyposulfite.
♦ Soufre végétal : soufre de lycopode.
2 Mod. Corps simple (symb. S; masse at. 32,066; no at. 16; fusion à 119 °C; ébullition à 444,6 °C) qui se rencontre dans la nature soit à l'état d'élément (soufre natif), soit à l'état de sulfures. || Le soufre, métalloïde polymorphe (⇒ Allotropie). || Principales formes allotropiques du soufre : soufre orthorhombique (dens. 2,07), corps cassant, de couleur jaune citron, se transformant à 95,6 °C en soufre clinorhombique (dens. 1,96); soufre nacré (instable); soufre-lambda, soufre-mu, soufre-mou (ces trois dernières variétés sont amorphes). || Le soufre, corps connu de toute antiquité, mais dont la nature élémentaire ne fut reconnue que par Lavoisier, était considéré par les alchimistes comme une condensation de la matière du feu contenue dans tous les corps combustibles (→ ci-dessus, 1.). || Soufre sublimé (ou fleur de soufre), obtenu par condensation brusque des vapeurs de soufre. || Soufre trituré, pulvérulent. || Soufre brut. || Soufre en canons, moulé en cylindres. || Soufre précipité (ou magistère de soufre) : soufre officinal obtenu dans certaines conditions. || Composés du soufre. ⇒ Bisulfure, hyposulfureux, mercaptan, oxysulfure, persulfure, pyrite, sulfate, sulfhydrique, sulfovinique, sulfure, sulfureux, sulfurique; et aussi préf. thio(n)-. — Combiner un corps avec du soufre. ⇒ Sulfurer. || Enlever le soufre d'une substance. ⇒ Désulfurer. || Le soufre, substance minéralisatrice (→ aussi Minéralisation, cit.). || Gisement (⇒ aussi Solfatare, soufrière), minerai de soufre. || Traitement, raffinage du soufre par cristallisation, fusion… || Usages du soufre dans l'industrie, les métiers : fabrication du gaz sulfureux, de l'acide sulfurique, du sulfure de carbone, des thiosulfates, de la pâte à papier, des insecticides, des fongicides; industrie du caoutchouc (⇒ Vulcanisation); métallurgie; raffinage des pétroles; fabrication de la poudre noire, des pièces d'artifice, de l'ébonite, de certains colorants; méchage des tonneaux; scellement du fer dans la pierre; moulage des médailles, etc. || Utilisation du soufre dans l'agriculture (protection de la vigne contre l'oïdium), en médecine (pommade au soufre contre la gale; fleur de soufre utilisée comme purgatif, etc.). || Imprégner de soufre. ⇒ Ensoufrer, soufrer.
1 Les allumettes se brisaient entre ses doigts. Il réussit à en allumer une. Le soufre se mit à bouillir, à enflammer le bois avec une lenteur qui redoubla les angoisses de Laurent; dans la clarté pâle et bleuâtre du soufre, dans les lueurs vacillantes qui couraient, il crut distinguer des formes monstrueuses.
Zola, Thérèse Raquin, XVII.
➪ tableau Noms de remèdes.
♦ Odeur de soufre : odeur qui se dégage du soufre en combustion. || L'odeur pointue (cit. 3) de la poudre et du soufre. — ☑ L'odeur de soufre : odeur infernale et satanique selon la légende (→ aussi Enfer, cit. 15; repoussement, cit. 2).
♦ ☑ Loc. fig. Sentir le soufre, se dit d'écrits ou de propos peu orthodoxes, dont la liberté paraît diabolique.
2 (…) le magicien Urbain l'avait ensorcelée avec des roses que le diable lui avait données, et il est sorti de ses oreilles et de son cou des roses couleur de flamme, qui sentaient le soufre au point que monsieur le lieutenant criminel a crié que chacun ferait bien de fermer ses narines et ses yeux, parce que les démons allaient sortir.
A. de Vigny, Cinq-Mars, II.
3 (1782). Moulage en soufre (d'une médaille).
4 (1742, in D. D. L.). Couleur d'un jaune clair semblable à celle du soufre (→ Pivert, cit.). — Par appos. || Jaune (cit. 10) soufre.
➪ tableau Désignations de couleurs.
❖
DÉR. Soufré, soufrer, soufreux, soufrière.
COMP. Ensoufrer.
HOM. Formes des v. souffrir et soufrer.
Encyclopédie Universelle. 2012.