- ЭЛЕКТРОЛИЗ
-
совокупность электрохим. процессов, проходящих на электродах, погружённых в электролит, при прохождении по нему электрич. тока. В результате этих процессов в-ва, входящие в состав электролита, выделяются в свободном виде.Проводимость электролитов — ионная, прохождение тока в них связано с переносом в-ва. На аноде происходит электрохим. окисление отрицательно заряж. ионы становятся нейтр. атомами и выделяются из р-ра, а на катоде — восстановит. реакция: положит. ионы получают недостающие эл-ны.Изучение и применение Э. началось в кон. 18 — нач. 19 вв. Осн. законы Э. были установлены экспериментально М. Фарадеем в 1833—34. Согласно первому закону Фарадея, масса m выделившегося на аноде в-ва пропорц. времени t прохождения через электролит тока и силе тока I:m=kIt;коэфф. пропорциональности k наз. электрохимическим эквивалентом данного в-ва.Второй закон Фарадея устанавливает связь электрохим. эквивалента с химическим эквивалентом А—m/n, где m — молярная (или атомная) масса, n — заряд иона (в ед. абс. величины заряда эл-на е):k=(1/F)A,где F — Фарадея постоянная, численно равная заряду, к-рый должен пройти через электролит, чтобы на электроде выделилась масса в-ва, численно равная k. Этот заряд переносят ионы, кол-во к-рых в массе в-ва, численно равной хим. эквиваленту, составляетNA/n ,где NA— число Авогадро (число молекул в грамм-молекуле).Поэтому F=qn(NA/n),где qn — заряд одного иона. Так как заряд иона qn=ne, то F=eNA = 96500 Кл/моль.Э. лежит в основе электрохим. метода получения чистых в-в, а также используется для создания тонких слоев одних в-в на поверхности других (никелирование, хромирование и Т. Д.).
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
- ЭЛЕКТРОЛИЗ
-
(от электро... и греч. lysis - разложение, растворение, распад) - совокупность электрохим. реакций (т. е. хим. реакций с участием свободных электронов), протекающих на поверхностях электродов в гальванич. цепи при пропускании через неё электрич. тока от внеш. источника и приводящих к хим. разложению растворителя или др. компонентов электролита (ионного проводника) и к образованию новых веществ. Если ток возникает в результате действия самой гальванич. цепи, то говорят о то-кообразующих реакциях.
Гальванич. цепь - электрич. цепь из последовательно включённых электронных и ионных проводников. В простейшем случае может быть представлена схемой
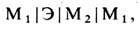
где М 1 и М 2 - электронные проводники (металлы), Э - электролит (напр., раствор к-ты, основания или соли, расплав соли и т. д.). Электрохим. реакция в гальванич. цепи сосредоточена на поверхности электродов, т. е. в местах контакта электронного и ионного проводников. В этих местах поток электронов в первом проводнике сменяется на поток ионов во втором. Электрохим. реакция служит стоком заряж. частиц, подходящих из объёма фазы к поверхности раздела, и источником частиц, отходящих от поверхности в глубь фазы. В результате обеспечивается непрерывность электрич. тока ("эстафетная" передача зарядов) и предотвращается накопление или исчезновение заряж. частиц в поверхностном слое. Электрохим. реакции подчиняются з а к о н а м Ф а р а д е я (М. Faraday, 1833- 1834), согласно к-рым кол-во превращаемых в реакции веществ строго пропорционально кол-ву прошедшего через гальванич. цепь электричества, а также пропорционально хим. эквивалентам (отношениям молярной массы к кол-ву электронов, участвующих в реакции одной молекулы) каждого вещества.
Характер электрохим. реакций зависит от хим. природы контактирующих проводников и от направления тока. На аноде (металлич. электроде, из к-рого ток переходит в ио-нопроводящий проводник - электролит) протекают реакции окисления с выделением свободных электронов, на катоде (обратное направление тока) - реакции восстановления с потреблением электронов из металла. При Э. анод - положительный электрод гальванич. цепи, катод - отрицательный. Примером анодной реакции является электролитич. выделение хлора из хлоридных растворов или расплавов на металлич. электроде
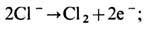
в результате реакции на поверхности раздела прекращается поток ионов Cl- в электролите и возникает поток электронов в металле. Примером катодной реакции является электролитич. выделение водорода из водных растворов электролитов
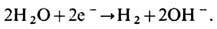
В замкнутой цепи катодная и анодная реакции сопряжены и протекают с одинаковой скоростью, т. е. выделяющееся в единицу времени на аноде кол-во электронов равно кол-ву электронов, вступающих за это время в реакцию на катоде. В ур-нии общей хим. реакции, протекающей в цепи в целом, электроны в явном виде уже не фигурируют. Для упомянутого примера реакций на аноде и катоде общая реакция имеет вид
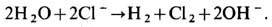
Э. используют для производства ряда веществ путём электрохим. превращений компонентов электролита - растворителя, растворённых или расплавленных солей, специально добавляемых веществ и т. д. Э. концентрированных растворов К Сl с вышеприведёнными реакциями ("хлорный Э.") лежит в основе промышленного производства хлора (мировой объём ок. 30 млн. т в год) и щёлочи (ок. 35 млн. т в год). Широко распространён Э. растворов или расплавов солей разных металлов с катодным восстановлением ионов металлов с целью производства этих металлов (электрометаллургия) или их осаждения в виде тонкого защитного или декоративного слоя на основу из др. металла (электроосаждение, гальваностегия). Производство алюминия (ок. 15 млн. т в год) основано на Э. эвтектич. смеси кремнезёма и расплавленного криолита при темп-ре 950 °С. Э. применяют также для производства или рафинирования большинства др. цветных металлов. С помощью Э. на аноде получают сильные окислители - фтор, перхлораты, персульфаты, перманганаты и др. Э. используют также для синтеза нек-рых органич. веществ, напр. себациновой кислоты (на аноде, из метанольного раствора моноэфира адипиновой кислоты), адипонитрила (на катоде, из раствора акрилнитрила) и др.
Реакции Э. проводят в спец. электролизёрах (электроли-тич. ячейках, гальванич. ваннах), основными составными частями к-рых являются блоки положительных и отрицательных электродов, электролит, межэлектродные сепараторы (для разделения продуктов реакций на аноде и катоде), корпус (бак) и системы регулирования.
Осн. параметры реакций Э.: плотность тока на аноде и катоде (отношение общей силы тока к площади поверхности соответствующего электрода), напряжение на выводах (клеммах) электролизёра. В зависимости от характера электрохим. реакций и природы целевого продукта применяют плотности тока от 10 до 104 А/м 2. Напряжение на выводах отд. электролизёра составляет 2-5 В. Часто соединяют электролизёры последовательно в секции (группы) с общим напряжением 200-400 В. Наиб. мощные промышленные электролизёры рассчитаны на токи порядка 100 кА. В. С. Багоцкий.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
.