MITOCHONDRIES
Vers 1890, Altman découvre dans les cellules des granules très semblables en dimensions et aspects à des bactéries. Il leur donne le nom de bioblastes. En 1897, le terme de mitochondries est introduit par Benda pour désigner ces éléments. On pensait, à cette époque, que les mitochondries devaient jouer un rôle essentiel dans le métabolisme cellulaire et notamment, entre autres fonctions, constituer le site de synthèse des protéines.
Le cycle de Krebs ayant été mis en évidence dans des broyats de muscle de pigeon vers 1940, les travaux de Keilin et Warburg amènent à interpréter les oxydoréductions cellulaires comme des transports d’électrons catalysés par des flavoprotéines et des cytochromes. Or, à la même époque, Claude mais surtout Palade, en 1948, obtiennent des fractions de mitochondries isolées, et la localisation du cycle de Krebs et de la 廓-oxydation des acides gras dans les mitochondries sont respectivement démontrées par Green et Lehninger en 1948. C’est le moment aussi où Boris Ephrussi publie les premières observations sur les mutants «petite colonie» des levures et jette les bases de la génétique extrachromosomale et mitochondriale. L’ensemble de ces travaux ouvrait un des domaines les plus féconds de la biologie moderne, domaine où devait s’opérer une conjonction entre bioénergétique, biologie des membranes et biologie moléculaire.
On sait aujourd’hui que les mitochondries sont le site de synthèse de la presque totalité de l’ATP (acide adénosine-triphosphorique) utilisé par les cellules. L’ATP, molécule riche en énergie, est le vecteur intracellulaire universel de l’énergie. Il est indispensable à toutes les réactions exigeantes en énergie des organismes vivants: réactions chimiques de biosynthèse, travail mécanique, transports actifs, bioluminescence, etc. Un calcul simple montre qu’un individu, recevant une ration journalière de 3 000 kcal, synthétise, en une journée, à peu près l’équivalent de son poids en ATP. Les tissus particulièrement exigeants en ATP seront donc très riches en mitochondries: 40 à 50 p. 100 du volume cellulaire du myocarde est précisément occupé par les mitochondries qui fournissent à ce muscle l’énergie indispensable aux contractions régulières des myofibrilles.
1. Structure des mitochondries
Ultrastructures membranaires
Les mitochondries ont des dimensions très voisines d’une bactérie (Escherichia Coli) : de 1 à 2 猪m de long, de 0,5 à 1 猪m de large. La fixation des tissus au tétraoxyde d’osmium fait apparaître autour de chaque mitochondrie un double système membranaire ; chaque membrane a une épaisseur de 6 à 8 nm (1 nm = 10-9 m). La membrane externe (fig. 1), régulièrement convexe, est séparée de la membrane interne par l’espace intermembranaire, dont l’épaisseur peut varier selon les conditions imposées à la mitochondrie. La membrane interne s’invagine en villosités ou crêtes délimitant la matrice. On peut mettre en évidence dans la matrice de petites molécules d’ADN circulaire et des ribosomes. La surface développée par la membrane interne peut être considérable, et cette surface est d’autant plus élevée que les mitochondries sont actives sur le plan énergétique. Dans les mitochondries de muscle alaire d’insecte, cette surface peut atteindre 400 m2/g de protéines mitochondriales, dans le myocarde 250 m2, dans le foie 40 m2. À titre indicatif, 100 g de muscle cardiaque peuvent contenir de 3 à 4 g de protéines mitochondriales. Le volume matriciel peut subir d’importantes variations selon les conditions physiologiques: il peut diminuer d’environ 50 p. 100 dans des conditions respiratoires intenses (état condensé); conjointement, on note un épaississement de la membrane interne.
Par des techniques spéciales dites de «coloration négative à l’étain», FernandezMoran (fig. 2) devait démontrer, en 1962, que la face matricielle de la membrane interne est porteuse d’excroissances globulaires d’environ 10 nm de diamètre que Racker devait isoler en 1965. Ces particules constituent le site catalytique 1 de l’ATP synthétase mitochondriale, site relié par un pédoncule d’environ 5 nm de longueur à la composante hydrophobique 0 localisée dans la membrane interne.
Aspects dans la cellule vivante
La présence des mitochondries est détectée dans toutes les cellules eucaryotes. Dès 1912, Kinsbury, en utilisant le vert Janus, mettait en relief le rôle des mitochondries dans les oxydations cellulaires. Le vert Janus ne colore les mitochondries que dans la mesure où elles consomment de l’oxygène. Ce colorant est en effet un couple redox qui, en absence d’oxygène, donne un leucodérivé incolore. En anaérobiose, les mitochondries ne sont pas ou très peu colorées par le vert Janus.
Aujourd’hui, l’étude de la distribution des mitochondries in vivo est grandement facilitée par l’utilisation de colorant fluorescent comme la Rhodamine 123. On peut constater que les mitochondries sont des systèmes vésiculaires très facilement déformables par les mouvements du cytoplasme. Elles peuvent s’associer en filaments ou se disperser. L’aspect filamenteux et l’épaississement des mitochondries seraient liés à l’âge des cellules. Les mitochondries augmenteraient de volume dans certaines conditions pathologiques: des rats nourris avec des régimes carencés en riboflavine ou en cuivre ont des mitochondries hépatiques dix fois supérieures en volume à celles d’animaux nourris normalement.
Isolement et composition biochimique
Les mitochondries sont extraites de tissus animaux ou végétaux par broyage des cellules dans des conditions isotoniques et à pH physiologique. Une première centrifugation permet d’éliminer, dans la zone 1 000-1 500 g , les débris membranaires et les noyaux des cellules. Une seconde centrifugation du surnageant précédemment obtenu permet de précipiter, dans la zone 10 000-20 000 g , les mitochondries. La séparation des différentes membranes et compartiments mitochondriaux peut s’effectuer ensuite par deux types de techniques: la technique des chocs osmotiques, et l’utilisation de la digitonine, un stéroïde d’origine végétale qui, à faible concentration, désagrège la membrane externe. On obtient, dans ce dernier cas, des mitoplastes. Traités aux ultrasons, ces mitoplastes sont fragmentés en parcelles de membrane interne qui peuvent se replier sur elles-mêmes et former des subparticules. Ces fractionnements permettent de déterminer la composition en lipides des membranes mitochondriales et la localisation des protéines dans les membranes, l’espace intermembranaire et la matrice.
Les composantes phospholipidiques majeures des membranes mitochondriales sont la phosphatidylcholine, la phosphatidyl-éthanolamine et la cardiolipine. La membrane externe se caractérise par un rapport protéine/lipide de 1,2 à 1,5 et une faible proportion de cardiolipine (3 p. 100 des phospholipides). La membrane interne a quatre fois plus de protéines que de phospholipides, et la proportion de cardiolipine est de 21,5 p. 100. Cette cardiolipine influe sur l’activité des enzymes de la membrane interne.
Au moins 300 protéines différentes peuvent être décelées par électrophorèse bidimensionnelle des protéines mitochondriales. Quelques enzymes clefs ont pu être localisées (tabl. 1).
2. Fonctions mitochondriales
Les oxydoréductions biologiques
Les différentes formes de l’énergie libre dans une cellule
L’énergie libre (ou enthalpie libre) est, par définition, l’énergie que l’on peut récupérer sous forme de travail. Elle est donnée par l’équation générale du second principe de la thermodynamique:
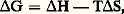
où G est la variation d’énergie libre, H la variation d’enthalpie, T la température absolue et S la variation d’entropie. Dans une cellule, le catabolisme des substrats provenant de l’alimentation conduit à l’accumulation et à l’utilisation de trois formes d’énergie libre: l’énergie d’oxydoréduction résultant de l’échange de protons (H+) et d’électrons (e -) entre couples redox, les dérivés riches en énergie dont le plus important est l’ATP, le potentiel électrochimique formé au niveau des membranes. Nous verrons que les mitochondries constituent un remarquable exemple de l’interconvertibilité de ces différentes formes d’énergie libre:

L’énergie d’oxydoréduction
La plupart des réactions chimiques rencontrées dans les cellules sont des réactions d’oxydoréduction. Par définition, une réaction d’oxydoréduction est constituée de deux couples oxydoréducteurs pouvant exister dans leur forme réduite et leur forme oxydée:
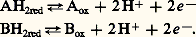
Si le couple A a la plus grande pression de H+ et d’électrons, il est le plus réducteur. La réaction s’effectuera de la façon suivante:
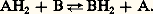
Le potentiel d’oxydoréduction E d’un couple est donné par l’équation de Nernst:
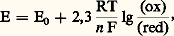
où R = 8,313 joules, F = 96 486 coulombs, n = le nombre des e - mis en jeu (2 généralement en biologie), (ox) et (red) sont les concentrations des formes oxydées et réduites. E0 représente le potentiel redox standard. En biologie, E0 devient E 0. Il est défini comme la force électromotrice en volts donnée par une électrode placée dans une solution 1 M en forme réduite et oxydée du couple considéré, à 25 0C et à pH = 7. L’électrode de référence est l’électrode à H2 qui a une f.e.m. maintenue arbitrairement à 0 avec une concentration en H+ 1 M (pH = 0) en équilibre avec H2 gaz à la pression de l’atmosphère. Dans ces conditions, l’équation de Nernst peut s’écrire:

C’est une convention, en biologie, de donner une valeur négative aux couples plus réducteurs que le couple H2/2H+ à pH = 0, et une valeur positive aux couples qui le sont moins. Le tableau 2 donne les valeurs de E 0 de quelques-uns des couples les plus importants rencontrés dans les cellules. Les couples les plus réducteurs sont des couples comme le glycérate, impliqué dans la glycolyse cytoplasmique, ou la ferredoxine, un des transporteurs d’électrons les plus importants de la photosynthèse dans les chloroplastes des cellules végétales. Le couple le plus oxydant est celui de 2/H2O. À partir des valeurs de E 0, on peut calculer la variation d’énergie libre standard G 0 résultant d’une réaction d’oxydoréduction en appliquant la relation:

où n est le nombre d’électrons mis en jeu dans la réaction, F le faraday et E 0 le saut de potentiel. On peut, par exemple, calculer le G 0 de la réoxydation du NADH + H+ par l’oxygène de l’air catalysée par la chaîne respiratoire:

C’est une réaction très exergonique qui libère une forte quantité d’énergie libre.
Mitochondrie et chloroplaste dans le cycle énergétique
Respiration et photosynthèse sont des phénomènes biologiques caractéristiques de la nutrition cellulaire mais thermodynamiquement tout à fait opposés.
Dans la mitochondrie, le transit des H+ et des électrons se fait, normalement, des couples les plus réducteurs vers le couple le plus oxydant, celui de l’oxygène. Ce transit correspond à ce que l’on appelle le sens thermodynamique. Il est le support moléculaire du phénomène de respiration. C’est au cours de la cascade des électrons, provenant du NADH + H+ et du FADH2, vers l’oxygène de l’air que sera récupérée l’énergie libre indispensable à la synthèse de l’ATP.
En revanche, dans un chloroplaste qui fixe l’énergie lumineuse, les phénomènes sont thermodynamiquement inversés. Nous partons de l’eau à potentiel réducteur très bas (+ 820 mV) et nous obtenons du NADPH + H+ à potentiel réducteur élevé (face=F0019 漣 320 mV). L’énergie nécessaire pour remonter le sens thermodynamique est apportée par les photons solaires (fig. 3).
La genèse du pouvoir réducteur dans les mitochondries
Le métabolisme mitochondrial est orienté vers la production continue de NADH + H+ et de FADH2, cofacteurs de nombreuses réactions enzymatiques, vecteurs des H+ et des électrons provenant de l’oxydation des substrats et ultérieurement réoxydés par la chaîne respiratoire (fig. 4). Les substrats cellulaires essentiels sur le plan énergétique sont les acides gras et le pyruvate, produit terminal de l’oxydation du glucose, du glycogène ou du lactate dans le cytoplasme. Les corps cétoniques comme le 廓-hydroxybutyrate ou les acides aminés interviennent de façon moins importante, dans des conditions normales, pour la production d’ATP. Dans les mitochondries, acides gras et pyruvate sont transformés en acétyl-coenzyme A, qui sera le substrat du cycle de Krebs.
L’oxydation des acides gras
Dans le cytoplasme, les acides gras sont tout d’abord estérifiés en acyl-CoA avant de former un complexe covalent avec la carnitine qui leur sert de vecteur pour le transport au travers des membranes mitochondriales. Dans la matrice mitochondriale, les acides gras seront retransformés en acyl-CoA avant d’être dégradés par les réactions de la 廓-oxydation (fig. 5). À chaque «tour» du cycle, générateur d’une molécule (dicarbonée) d’acétyl-CoA, il y a synthèse de 1 mole de FADH2 et de 1 mole de NADH + H+. Un acide gras comme l’acide palmitique [CH3 漣(CH2)14 漣COOH] sera ainsi clivé en 8 molécules d’acétyl-CoA au cours de 7 廓-oxydations génératrices de 7 FADH2 et 7 NADH + H+.
La transformation du pyruvate en acétyl-coenzyme A
C’est une réaction de décarboxylation oxydative que l’on peut écrire globalement de la façon suivante:

Elle est catalysée par un système multienzymatique complexe, en suspension dans la matrice mitochondriale et dont la première enzyme est la déshydrogénase pyruvique. Le C2 formé au cours de cette réaction est la première molécule de ce gaz rejetée par la respiration.
L’oxydation de l’acétyl-coenzyme A par le cycle de Krebs
L’étape initiale (fig. 6) est la condensation du radical acétyle (sous forme d’acétyl-CoA) à 2 atomes de carbone avec une molécule à 4 atomes de carbone produite par le cycle de Krebs: l’oxaloacétate. Il en résulte la formation de citrate, acide tricarboxylique à 6 atomes de carbone. Cette réaction est catalysée par la citrate synthétase. Les 7 autres réactions enzymatiques vont ensuite catalyser la décarboxylation oxydative du citrate et la régénération de l’oxaloacétate. Deux molécules de C2 seront ainsi rejetées, et les électrons apportés par le radical acétyle se retrouveront sous forme de 3 moles de NADH + H+ et de 1 mole de FADH2. Une réaction est particulièrement intéressante sur le plan énergétique. C’est la réaction 5 catalysée par la thiokinase succinique. Au cours de cette réaction, une molécule de GTP est synthétisée. Elle réagit ensuite avec de l’ADP:
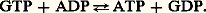
Une molécule d’ATP est ainsi synthétisée dans les mitochondries sans passer par la chaîne respiratoire. Le mécanisme de cette synthèse est dit par «phosphorylation liée au substrat». Il est analogue à celui de la synthèse d’ATP lors de la glycolyse dans le cytoplasme.
Chaque molécule d’acétyl-CoA métabolisée par le cycle de Krebs donne donc lieu à la synthèse de 3 NADH + H+, 1 FADH2 et 1 ATP. Nous verrons que la réoxydation par la chaîne respiratoire de 1 mole de NADH + H+ permet de récupérer 3 moles d’ATP, celle de 1 mole de FADH2, 2 moles d’ATP. Ainsi, 12 moles d’ATP sont synthétisées toutes les fois qu’un radical acétyle est métabolisé par le cycle de Krebs.
Le métabolisme des acides aminés
La part du métabolisme des acides aminés dans la synthèse d’ATP mitochondriale est relativement limitée. En revanche, les mitochondries de foie catalysent les étapes essentielles du cycle de l’uréogenèse. Par le jeu des réactions catalysées par les transaminases cytoplasmiques, l’ammoniac provenant des acides aminés se retrouve sous forme de glutamate qui diffuse dans les mitochondries. Dans la matrice mitochondriale, le glutamate est désaminé dans une réaction catalysée par la déshydrogénase glutamique. L’ammoniac formé est récupéré sous forme de carbamyl phosphate, substrat initial du cycle de formation de l’urée. Ce cycle met en jeu des transports, au travers des membranes mitochondriales, d’ornithine et de citrulline puisque, en fin de compte, l’urée est synthétisée dans le cytoplasme.
La réoxydation des cofacteurs réduits par la chaîne respiratoire
Les couples oxydoréducteurs de la chaîne respiratoire
Le transfert des électrons depuis les cofacteurs réduits (NADH + H+ et FADH2) jusqu’à l’oxygène de l’air se fait par l’intermédiaire d’enzymes constituées de protéines spécifiques et de groupements prosthétiques qui sont des couples redox (cf. OXYDORÉDUCTIONS BIOLOGIQUES, tabl. 3). Un seul couple fait exception, il s’agit de l’ubiquinone (tabl. 3), qui est soluble dans la phase phospholipidique des membranes. Les autres couples sont des structures de type flavinique (FMN, FAD) et des cytochromes. Ces derniers sont constitués d’un noyau hémique dont les 4 atomes d’azote sont reliés par des liaisons de coordination au fer qui est le couple redox du système (Fe++/Fe+++); deux autres liaisons de coordination relient le fer à la protéine spécifique. La chaîne respiratoire mitochondriale comporte les cytochromes b , c 1, c , aa 3 que l’on peut identifier par des pics d’absorption spécifiques de la lumière visible (bandes 見, 廓, 塚). Par spectrophotométrie différentielle, on peut mettre en évidence les variations d’absorption des cytochromes en absence et en présence d’oxygène (fig. 7). Le fer intervient non seulement dans la structure des cytochromes mais aussi dans la formation de complexe de fer non hémique (Fe 漣S) où l’ion Fe est relié par des liaisons de coordination à du soufre labile et à des groupements thiols des protéines. Le fer n’est pas le seul métal intervenant dans le transfert des électrons catalysé par la chaîne respiratoire; du cuivre est rencontré dans la structure de la cytochrome oxydase (cytochrome aa 3), l’enzyme terminale de la chaîne respiratoire.
L’organisation de la chaîne respiratoire
Le fractionnement de la membrane interne des mitochondries permet d’isoler 4 complexes multienzymatiques (I, II, III et IV) comportant des phospholipides, des protéines et des couples redox (tabl. 3). Ces complexes fortement intégrés à la membrane interne sont tous insolubles et ne peuvent être dissociés qu’en utilisant des détergents. Seul le cytochrome c est très soluble et se dissout facilement dans le surnageant de la préparation. Enfin, l’ubiquinone liposoluble est extraite par des solvants non polaires.
La première hypothèse quant à l’organisation de la chaîne respiratoire a consisté à positionner les différents couples redox rencontrés dans chacun des complexes en fonction de leur E 0, les plus réducteurs en amont, les plus oxydants en aval. Le complexe I (fig. 8, tabl. 3) reçoit les électrons provenant des substrats oxydés par des enzymes à NAD et à NADP (E 0 = 漣 320 mV); le NADP transfère ses équivalents réducteurs au NAD par l’intermédiaire d’une transhydrogénase. Par une série de réactions d’oxydoréduction, les électrons sont transférés à l’ubiquinone (UQ), d’où le nom de NADH ubiquinone réductase donné à ce système multienzymatique. À titre d’exemple, on peut donner la série des 6 réactions d’oxydoréduction catalysées par le complexe I en fonction des potentiels redox des différents éléments.
Le complexe II récupère les électrons provenant du succinate. Le succinate a un E 0 de + 30 mV et est oxydé par un complexe II, comportant dans sa structure du FAD dont le E 0 théorique est de 漣 220 mV (tabl. 2). Comment un couple redox (succinateumarate) nettement oxydant pourrat-il transférer ses équivalents réducteurs à un couple nettement plus réducteur (FAD/FADH2)? En fait, on devait démontrer que la fixation covalente du FAD sur une protéine du complexe II modifie son potentiel redox et le rend très voisin de celui du succinate. Ce complexe II transfère lui aussi ses équivalents réducteurs à l’ubiquinone. Du fait de sa forte concentration (tabl. 3), l’ubiquinone joue un rôle central dans la chaîne respiratoire. Des équivalents réducteurs peuvent lui être apportés par d’autres substrats utilisant des flavoprotéines spécifiques. C’est le cas des acides gras et du glycérophosphate, tous deux générateurs, dans leur métabolisme, de FADH2. Les électrons vont ensuite transiter jusqu’à l’oxygène de l’air par l’intermédiaire du complexe III dont les éléments majeurs sont les cytochromes b et c 1, puis le cytochrome c (E 0 = + 250 mV) qui peut éventuellement recevoir des électrons de l’ascorbate ou vitamine C. Le complexe IV ou cytochrome oxydase catalyse enfin le transfert des électrons sur l’oxygène de l’air. La réaction finale de la chaîne respiratoire est:
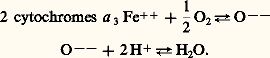
Deux molécules de cytochrome a 3 réduit (Fe++) sont nécessaires puisque chaque molécule de NADH + H+ ou de FADH2 cède 2 H+ et 2 électrons à la chaîne respiratoire. L’eau formée tout à fait en aval de la chaîne respiratoire est l’eau résiduelle de la respiration. La description de la chaîne que nous venons de donner est celle des mitochondries animales. À quelques variantes près, les mitochondries végétales présentent la même organisation.
Cette organisation thermodynamique de la chaîne respiratoire, résultant de la détermination du E 0 de chacun des couples redox par des méthodes spectrophotométriques ou plus récemment par des méthodes potentiométriques, est parfaitement corrélée avec une approche cinétique de son fonctionnement. Il a été démontré que, dans des conditions d’état stationnaire, en présence d’oxygène et de substrat, les transporteurs au voisinage de l’oxygène sont beaucoup plus oxydés que les couples redox situés en amont de la chaîne. De la même façon, lorsqu’un «pulse» d’oxygène est introduit dans des mitochondries en anaérobiose la vitesse de réoxydation est décroissante du cytochrome a 3 au NAD. Les facteurs limitants du fonctionnement de la chaîne sont en amont, surtout au niveau du FAD et du FMN des complexes I et II.
Les inhibiteurs de la chaîne respiratoire
Ces études cinétiques ont été corroborées par l’utilisation des inhibiteurs. Chacun des complexes (fig. 8) peut être inhibé spécifiquement. Le blocage du transfert des électrons par la roténone (complexe I) n’empêche pas les mitochondries d’oxyder du succinate ou de l’ascorbate. Le blocage de la chaîne respiratoire par l’antimycine (complexe III) n’empêche pas l’oxydation de l’ascorbate. En présence d’antimycine, d’un substrat à NAD et d’oxygène, on peut démontrer que tous les couples redox en amont du cytochrome c 1 sont réduits; ceux en aval, les cytochromes c et aa 3, sont oxydés: l’antimycine inhibe donc le transfert des électrons entre le cytochrome b et le cytochrome c 1. La cytochrome oxydase (complexe IV) est particulièrement sensible aux inhibiteurs. Le cyanure bloque complètement toute respiration en se fixant par liaison de coordination sur l’atome de fer du cytochrome a 3 à la place de l’oxygène.
Le couplage entre le transfert des électrons et la syntèse d’ATP
Les arguments d’ordre thermodynamique
La synthèse de 1 mole d’ATP est une réaction endergonique qui requiert + 32,6 kJ . mole-1. L’hydrolyse de l’ATP est exergonique et libère une quantité équivalente d’énergie.
L’organisation de la chaîne (fig. 8) montre qu’il existe 3 sites principaux de production de l’énergie d’oxydoréduction. Ce sont les sites (1), (2) et (3) correspondant respectivement aux complexes I, III et IV. Par la relation (face=F0019 蓮G 0 = 漣 nF 蓮E 0), il est possible, pour chacun d’eux, de calculer la variation d’énergie libre correspondante. Le calcul montre que les trois valeurs obtenues [ 漣 69,3 kJ mole-1 pour le site (1), face=F0019 漣 40,5 pour le site (2) et 109,4 pour le site (3)] sont toutes supérieures à la quantité d’énergie requise pour synthétiser une mole d’ATP. Une hypothèse peut donc être formulée: la réoxydation d’une mole de NADH + H+ devrait permettre la synthèse au moins de 3 moles d’ATP, la réoxydation de 1 mole de FADH2 la synthèse de 2 moles d’ATP.
Cela est vérifié expérimentalement par la détermination du rapport ATP synthétisé/oxygène consommé ou rapport P/O. En mesurant conjointement l’ATP synthétisé et l’oxygène consommé par des mitochondries oxydant un substrat à NAD, on constate que ce rapport est égal à 3. Il est de 2 lors de l’oxydation du succinate.
Les arguments d’ordre cinétique: les états respiratoires
Il est possible de faire in vitro des mesures précises de la consommation d’oxygène mitochondriale. Des mitochondries oxydant un substrat en présence de phosphate ont une respiration lente (fig. 9). L’addition d’ADP stimule fortement la consommation d’oxygène. Tout le phénomène de couplage est là. Il ne suffit pas qu’il y ait des électrons en amont de la chaîne respiratoire, de l’oxygène en aval, pour que la chaîne catalyse le transfert des électrons à sa vitesse maximale. C’est la présence d’ADP, et donc la synthèse d’ATP, qui contrôle la vitesse de la chaîne respiratoire. Il est ainsi possible de mesurer un contrôle respiratoire (RCR), qui est un indice du bon fonctionnement des mitochondries. En jouant sur les 3 paramètres substrat + phosphate, ADP et oxygène, on peut définir des états respiratoires. L’état respiratoire des mitochondries dans les cellules sera une fonction du rapport ATP/ADP et oscillera entre les états 4 et 3.
Le découplage des phosphorylations oxydatives
Le couplage étroit entre oxydation et synthèse d’ATP est encore accrédité par l’effet des découplants. Ce sont des molécules, le plus souvent des acides faibles relativement lipophiles, qui dissocient le phénomène de transfert d’électrons, catalysé par la chaîne respiratoire, du phénomène de synthèse d’ATP. En présence d’un découplant, il y a toujours oxydation d’un substrat, voire amplification de la consommation d’oxygène et de la consommation du substrat par rapport à l’état non découplé; en revanche, la synthèse d’ATP est complètement inhibée. Les découplants les plus classiquement utilisés in vitro sont des phénols, comme le 2-4 dinitrophénol (2-4 DNP), ou des molécules, comme le carbonide cyanide-p-trifluorométhoxyphénylhydrazone (FCCP). De nombreuses molécules peuvent avoir une action découplante: les acides gras, les dérivés des salicylates, etc.
La synthèse d’ATP par l’ATP synthétase
La synthèse d’ATP est catalysée par un système multi-enzymatique: l’ATP synthétase (fig. 10). Le site catalytique est localisé dans la sous-unité F1 composée de 5 polypeptides: 見, 廓 directement impliqués dans l’activité catalytique; 塚, 嗀, 﨎 impliqués dans la régulation. F1 comporte enfin un peptide I inhibiteur de l’hydrolyse de l’ATP par l’enzyme. L’ensemble a un poids moléculaire d’environ 360 000. F1 est rattachée à la membrane interne des mitochondries par l’intermédiaire d’une protéine (O.S.C.P.: oligomycin sensitivity conferring protein ) de poids moléculaire 18 000, qui est indispensable à la fixation d’un puissant inhibiteur de la synthèse d’ATP: l’oligomycine. L’oligomycine empêche le passage des protons à travers le canal constitué par un hexamère de 6 protéolipides (sous-unité 9 de poids moléculaire 8 000 environ chacune). D’autres protéines font partie de la structure de Fo, mais leur fonction est encore mal définie.
Une question reste posée: comment l’énergie d’oxydoréduction produite par la chaîne respiratoire est-elle récupérée pour la synthèse d’ATP? C’est à cette question que devait répondre la théorie chimiosmotique de P. Mitchell.
La théorie chimiosmotique de P. Mitchell
Les postulats
Trois postulats essentiels sont à la base de cette théorie:
– l’énergie d’oxydoréduction provenant du fonctionnement de la chaîne respiratoire est utilisée pour la translocation active de protons au travers de la membrane interne, depuis la matrice jusqu’au cytoplasme, créant ainsi une différence de potentiel électrochimique ou force protomotrice ; il y a donc couplage entre un phénomène chimique (les réactions d’oxydoréduction) et un phénomène osmotique (la translocation active des H+);
– les phosphorylations oxydatives requièrent une membrane couplante imperméable aux ions, sauf à ceux dont le transport est catalysé par des transporteurs spécifiques;
– il doit exister dans la membrane interne une ATP synthétase catalysant une rentrée des protons dans la matrice des mitochondries et utilisant ainsi pour la synthèse d’ATP la force protomotrice produite par la chaîne respiratoire.
La force protomotrice
La variation d’énergie consécutive à la translocation des protons est la résultante de l’énergie libre indispensable au transport des protons contre leur gradient de concentration (le pH est plus acide dans le cytoplasme que dans la matrice) et de l’énergie libre nécessaire pour vaincre la différence de potentiel électrique existant de part et d’autre de la membrane interne (la face cytoplasmique est chargée +, la face matricielle est chargée 漣). On a, en millivolts:
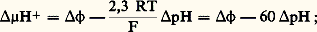
猪H+ = différence de potentiel électrochimique due aux protons, 﨏 = différence de potentiel électrique de part et d’autre de la membrane interne, pH = différence de pH de part et d’autre de la membrane interne. Il est possible de déterminer les valeurs en mV de 﨏 et de 漣 60 蓮pH. Pour 﨏, on peut, par exemple, apprécier à l’équilibre la diffusion de cations comme 86Rb+. La valeur de 﨏 est alors donnée par l’équation de Nernst:

Le 蓮pH peut être apprécié par la diffusion d’un acide faible marqué radioactivement. On obtient des valeurs de:

Pour la synthèse d’ATP, la force protomotrice produite par la chaîne respiratoire est récupérée par l’ATP synthétase grâce au canal à H+ de la composante Fo. Le mécanisme précis de la synthèse de l’ATP dans le site catalytique de F1 est encore mal connu. L’utilisation du 猪H+ pour synthétiser de l’ATP est un phénomène réversible. L’hydrolyse de l’ATP par l’ATP synthétase conduit à une accumulation de 猪H+ de part et d’autre de la membrane interne.
En présence d’un découplant, la valeur de 猪H+ est nettement diminuée, voire complètement annulée à concentration élevée de découplant. Cela est compréhensible si l’on se souvient que ces molécules sont des acides faibles lipophiles qui vont tendre à égaliser la concentration en H+ de part et d’autre de la membrane interne. En dissipant 猪H+, ils inhibent toute synthèse d’ATP.
Les vérifications expérimentales
– Il a tout d’abord été démontré par P. Mitchell (1969) que des mitochondries auxquelles on fait subir une transition rapide entre l’anaérobiose et l’aérobiose, dans des conditions faiblement tamponnées, acidifient le milieu dans lequel elles sont incubées. Toutes les fois qu’une mole de NADH + H+ est oxydée, un rapport H+/O (protons éjectés/atome d’oxygène consommé) égal à 6 est mesuré; il est de 4 pour une mole de FADH2. À l’heure actuelle, on estime que pour 2 électrons qui transitent du NADH + H+ à un atome d’oxygène, il y a 3 H+ éjectés par le complexe I, 4 H+ éjectés par le complexe III et 2 H+ éjectés par le complexe IV, soit 9 H+ en tout. Le mécanisme par lequel ces protons sont éjectés par la membrane reste à préciser: il est probable qu’il existe des canaux à protons au niveau de chacun des complexes.
– Les antibiotiques ionophores représentent des outils remarquables pour moduler l’intensité du potentiel électrique et du pH au niveau de la membrane interne des mitochondries. Ce sont des petites molécules (fig. 11) qui complexent le K+ et facilitent son transport au travers de la membrane interne. Ces molécules sont d’origine microbienne et ont été utilisées in vitro avec les mitochondries. (Néanmoins, dans certains types de mitochondries, des peptides cycliques, ionophores du calcium, ont pu être isolés.) La valinomycine transporte le K+ contre son gradient de concentration. C’est un transport actif qui consomme du potentiel électrique; la chaîne respiratoire répond en augmentant sa vitesse de fonctionnement, d’où une augmentation du pH. En revanche, la nigéricine, qui catalyse un échange K+ (matrice) 曆 H+ (cytoplasme), augmente le potentiel de membrane et annule le pH.
– Il est enfin possible de faire des reconstitutions partielles des membranes internes mitochondriales. On peut préparer à partir des phospholipides membranaires des liposomes qui sont des vésicules constituées d’une double couche de phospholipides. On inclut ensuite dans ces liposomes le complexe IV de la chaîne respiratoire et l’ATP synthétase. Il est ainsi possible de démontrer que le complexe IV se comporte comme un accumulateur de potentiel électrochimique, potentiel qui peut être utilisé par l’ATP synthétase pour la synthèse d’ATP.
Les interactions des mitochondries avec leur environnement
Les systèmes de transport de la membrane interne
Dans l’économie cellulaire, les mitochondries jouent un rôle majeur. L’ATP en effet est surtout synthétisé dans les mitochondries, mais essentiellement utilisé dans le cytoplasme. Les mitochondries reçoivent de l’oxygène, des substrats, de l’ADP et du Pi, elles rejettent du gaz carbonique, de l’eau et de l’ATP. Comment contrôlent-elles tous ces transports ?
L’oxygène, l’eau et le gaz carbonique diffusent sans contrôle au travers des membranes mitochondriales. En revanche, le transit des substrats et des produits du métabolisme mitochondrial est contrôlé par le potentiel électrochimique produit par la chaîne respiratoire. La synthèse d’ATP est directement liée à 2 systèmes de transport: la translocase des nucléotides et le transporteur du phosphate (fig. 12). La translocase des nucléotides est une protéine de poids moléculaire 30 000 qui catalyse un échange ADP3- (cytoplasme) 曆 ATP4- (matrice). C’est un système de transport qui est dit électrogénique et qui consomme du potentiel de membrane ( 﨏) au niveau de la membrane interne. Le transporteur du phosphate est une protéine de poids moléculaire 32 000 qui catalyse un co-transport électroneutre Pi2- 漣2H+. Il est directement contrôlé par le pH transmembranaire. Le transporteur du phosphate et d’autres transporteurs d’anions comme celui du pyruvate joue donc un rôle important dans la rentrée des protons dans la matrice mitochondriale catalysée principalement par l’ATP synthétase. On estime que deux tiers du potentiel électrochimique accumulé au niveau de la membrane interne sont utilisés pour la synthèse d’ATP, un tiers pour les transports actifs liés à cette synthèse.
D’autres transports actifs existent pour les cations. C’est le cas du calcium qui peut être transporté contre son gradient de concentration depuis le cytoplasme jusque dans la matrice. Son transport se fait en consommant du potentiel de membrane ( 﨏); il en résulte une stimulation du fonctionnement de la chaîne respiratoire qui tend à maintenir constante la valeur du 猪H+. Le mécanisme de ce transport est très analogue, sur le plan thermodynamique, au transport du K+ complexé avec la valinomycine.
Mitochondries et régulations cytoplasmiques
Le contrôle de la concentration en ATP du cytoplasme
La concentration en ATP du cytoplasme demeure à peu de chose près constante. Dans un muscle qui se contracte régulièrement et violemment, comme le muscle alaire d’insecte, la concentration en ATP ne diminue pas de plus de 20 p. 100 par rapport à l’état de repos. Les mitochondries sont donc capables de répondre rapidement aux exigences du cytoplasme. À l’état de repos, les rapports ATP/ADP et NADH/NAD+ augmentent dans les mitochondries et ralentissent le fonctionnement du cycle de Krebs, de la chaîne respiratoire et de l’entrée des substrats. Lors des phases de contraction, l’augmentation de la concentration d’ADP dans le cytoplasme consécutive à l’hydrolyse de l’ATP par les myofibrilles va stimuler l’échange ADP (cytoplasme) 曆 ATP (matrice) et entraîner une stimulation de l’activité mitochondriale. En fait, l’activité des mitochondries dans une cellule est régulée par le potentiel phosphate (ATP)/(ADP) (Pi) du cytoplasme et de la matrice; il existe dans la cellule un gradient de potentiel phosphate.
Le contrôle du métabolisme glycolytique par le métabolisme mitochondrial
C’est le contrôle dit par «effet Pasteur». Le métabolisme mitochondrial limite la vitesse de la glycolyse en aérobiose. Ce sont des produits du métabolisme mitochondrial, le citrate et l’ATP, qui rendent compte de ce phénomène. Ces deux molécules sont en effet des inhibiteurs allostériques d’une enzyme clef de la glycolyse, la phosphofructokinase.
Concentration intracellulaire de calcium et métabolisme mitochondrial
La concentration de calcium intracellulaire peut varier d’un facteur 100 dans certaines conditions physiologiques comme le processus de contraction musculaire (de 10-7 à 10-5 M lors de la dépolarisation de la membrane du sarcolemme). L’augmentation de concentration du calcium intracellulaire stimule le métabolisme oxydatif du glycogène et, dans les mitochondries, l’entrée des anions comme le phosphate, le pyruvate et l’oxydation par la désydrogénase pyruvique de ce substrat. Il est hautement probable que les mitochondries jouent un rôle régulateur de la concentration du calcium cytoplasmique par l’intermédiaire de 2 systèmes de transport: l’entrée active du calcium dans les mitochondries précédemment décrite, mais aussi la sortie par l’intermédiaire d’un système d’échange électroneutre Ca++ (matrice) 曆 2 Na+ (cytoplasme).
Mitochondries et translocation du pouvoir réducteur
Dans la plupart des cellules, le pouvoir réducteur (NADH + H+) produit par la glycolyse dans le cytoplasme doit être réoxydé par la chaîne respiratoire afin de récupérer le maximum d’ATP. Les mitochondries sont imperméables au NAD+ et au NADH + H+. Des systèmes indirects de translocation du pouvoir réducteur ont été mis en évidence. L’un d’entre eux (fig. 13) nécessite des formes isoenzymatiques de la déshydrogénase malique et de la transaminase glutamique oxaloacétique dans le cytoplasme et la matrice mitochondriale. Deux systèmes d’échange des anions sont en outre indispensables (échange malate 曆 見-cétoglutarate, échange glutamate 曆 aspartate).
Mitochondries et néoglucogenèse
La néoglucogenèse est une resynthèse de glucose à partir du squelette carboné de molécules comme le lactate et certains acides aminés. L’étape essentielle est une transformation de l’oxaloacétate en phosphoénolpyruvate ; le phosphoénolpyruvate est ensuite transformé en glucose par une séquence de réactions inversées de la glycolyse. L’oxaloacétate est un substrat produit par les mitochondries. Il ne peut diffuser librement au travers de la membrane interne des mitochondries. Il est tout d’abord converti en malate. Ce malate diffuse dans le cytoplasme par échange avec du phosphate, ou avec un acide dicarboxylique comme l’ 見-cétoglutarate provenant du cytoplasme. Dans le cytoplasme, le malate est retransformé en oxaloacétate.
Mitochondries et thermogenèse
Le potentiel électrochimique ( 猪H+) produit par la chaîne respiratoire est utilisé soit pour la synthèse d’ATP, soit pour des transports actifs. Dans certains types de mitochondries, comme celles du tissu adipeux, où la synthèse d’ATP est faible, il est directement dissipé en calories et rend compte du phénomène de thermogenèse à l’échelle moléculaire. Dans ce type de mitochondries, le cycle des protons au travers de la membrane interne est relativement simple: une éjection catalysée par les canaux de la chaîne respiratoire, une rentrée catalysée par une protéine de poids moléculaire 30 000-32 000. Ainsi, l’énergie d’oxydoréduction sert à produire de la chaleur.
3. Biogenèse
La continuité mitochondriale
Les mitochondries se reproduisent-elles par croissance et division ou bien par synthèse de novo? On sait maintenant qu’elles se reproduisent par croissance de cet organite par suite de la synthèse coordonnée des éléments moléculaires dont il est constitué. À partir d’un certain volume mitochondrial, il y a coupure de la membrane interne, formation de deux vésicules matricielles et segmentation de la membrane externe qui clôt les deux vésicules précédemment formées. La masse mitochondriale double à chaque mitose.
Cette continuité physique des mitochondries a été tout d’abord démontrée avec les phospholipides des membranes. Des mutants de Neurospora crassa , auxotrophes pour la choline indispensable à la synthèse de phosphatidylcholine, ont des mitochondries plus denses quand les cellules sont cultivées en absence de choline. L’addition de choline ne s’accompagne pas de la synthèse d’une nouvelle population de mitochondries moins dense, mais de la diminution progressive de densité de la population initiale des organelles. La continuité de la biogenèse des protéines est observée lors de la transformation des promitochondries des levures cultivées en anaérobiose en mitochondries lors de l’addition d’oxygène.
La biogenèse des mitochondries est un phénomène complexe mettant en jeu le génome nucléaire et le génome propre à la mitochondrie.
Les éléments de la synthèse protéique proprement mitochondriale
Les protéines synthétisées dans les mitochondries
Environ 10 p. 100 des protéines mitochondriales sont synthétisées dans les mitochondries. Ce sont des polypeptides très hydrophobes jouant un rôle majeur dans le fonctionnement de la chaîne respiratoire ou de l’ATP synthétase. À l’heure actuelle sont identifiées les sous-unités 1, 2 et 3 de la cytochrome oxydase, qui catalysent le transfert des électrons jusqu’à l’oxygène de l’air et l’éjection des H+ par le complexe IV; l’apocytochrome b ou protéine du cytochrome b directement impliqué dans le fonctionnement de ce cytochrome; deux sous-unités de l’ATP synthétase: la sousunité 9 qui constitue le canal à H+ de l’enzyme, une sous-unité 6 dont le rôle fonctionnel est mal connu. Dans les mitochondries de levures enfin, on a pu démontrer qu’une protéine des ribosomes mitochondriaux était synthétisée dans les mitochondries. Toutes ces protéines sont synthétisées sur les ribosomes mitochondriaux, elles sont dites mitoribosomales. Ces règles ne sont pas absolues. La sous-unité 9 de l’ATP synthétase peut être synthétisée dans le cytoplasme comme chez Neurospora crassa et l’homme; et pourtant il y a une grande homologie de séquence entre la sous-unité 9 de Neurospora crassa cytoribosomale et la sous-unité 9 de levure mitoribosomale.
L’ADN mitochondrial
Toutes les mitochondries ont leur propre génome: de l’ADN bicaténaire, circulaire, sauf exception où il est linéaire. Toutes les séquences sont identiques pour un même organisme. La taille de ces molécules d’ADN est relativement uniforme dans le règne animal et est caractéristique de l’espèce: 16 569 paires de bases pour l’ADN mitochondrial humain, 17 400 pour Xenopus laevis , de 15 700 à 19 500 pour la Drosophile. L’ADN mitochondrial de levures a environ 75 000 paires de bases. Le génome mitochondrial des plantes peut être de 20 à 30 fois plus grand que le génome de levure.
La séquence complète du génome mitochondrial humain a été publiée (Nature , avr. 1981). L’organisation de ce génome (cf. GÉNOME - Le génome mitochondrial) est tout à fait remarquable. Les gènes codant pour les 2 ARN ribosomaux, 22 ARN de transfert et 13 protéines sont tellement serrés qu’il n’y a pas de bases non codantes entre eux. Quelques codons ne sont pas conformes au code génétique universel: UGA, qui est un codon d’arrêt dans la synthèse cytoribosomale, code pour le tryptophane dans les mitochondries; AGA et AGG, qui codent habituellement pour l’arginine, sont des codons d’arrêt dans les mitochondries. En plus des gènes qui ont été identifiés, la séquence fait apparaître 8 zones de lecture codant pour des protéines dont on ignore la nature et la fonction. On connaît la séquence des nucléotides codant pour ces protéines, on peut en déduire la séquence primaire des protéines. On s’interroge sur leur rôle dans les mitochondries: enzymes? transporteurs membranaires? protéines de la machinerie de synthèse protéique?
Les protéines cytoribosomales indispensables à la synthèse protéique mitochondriale
Tous les ARN messagers traduits dans la matrice mitochondriale sont codés par l’ADN mitochondrial. Il n’y a pas de transit d’ARN messagers nucléaires dans la matrice aux fins de traduction sur les ribosomes mitochondriaux.
La machinerie de la synthèse protéique mitochondriale exige un ensemble de protéines cytoribosomales (fig. 14). Les plus connues, à l’heure actuelle, sont celles entrant dans la structure des ribosomes, celles impliquées dans la réplication de l’ADN mitochondrial (ADN polymérase), la transcription (ARN polymérase), la traduction des ARNm (aminoacyl ARNt synthétases, facteurs d’initiation, facteur d’élongation, etc.).
La biosynthèse des protéines mitochondriales
L’origine traductionnelle des sous-unités
Prenons le cas de la cytochrome oxydase dans la levure (complexe IV de la chaîne respiratoire). Les sous-unités 1, 2 et 3, qui catalysent la réduction de l’oxygène et l’éjection de protons, sont mitoribosomales. Les sous-unités 4, 5, 6 et 7, qui jouent un rôle régulateur, sont cytoribosomales.
L’origine traductionnelle de chaque groupe de sous-unités a été facilitée par l’utilisation d’antibiotiques inhibiteurs spécifiques de la biosynthèse des protéines dans le cytoplasme et dans les mitochondries. La traduction cytoribosomale peut être inhibée par la cyclohéximide qui bloque l’initiation et l’élongation des chaînes polypeptidiques. La traduction mitoribosomale peut être inhibée par le chloramphénicol qui agit en se fixant sur les ribosomes mitochondriaux.
La méthodologie suivie est simple. Des cellules de levure sont cultivées en présence de cyclohéximide et d’un acide aminé radioactif, la méthionine-35S. Aucune incorporation de l’acide aminé ne sera décelée dans les protéines d’origine cytoribosomale, qu’elles soient cytoplasmiques ou mitochondriales. En revanche, si l’on isole les mitochondries et que l’on purifie les sous-unités 1, 2 et 3 par immunopurification, on constate qu’elles sont radioactives. Ce résultat montre qu’elles sont synthétisées dans les mitochondries. Une expérience semblable effectuée avec du chloramphénicol permet de démontrer que les sous-unités 4 à 7 sont cytoribosomales.
L’incorporation de méthionine-35S dans des mitochondries isolées confirme les résultats précédents. Dans ces conditions, seules les protéines mitoribosomales incorporent la méthionine-35S. Et cette incorporation est inhibée par le chloramphénicol.
Une dernière voie d’approche de ce type de problème est la traduction in vitro des ARN messagers mitochondriaux. Elle n’est pas encore au point car l’isolement des ARN messagers est délicat, et leur traduction par les lysats de réticulocytes ou de germe de blé n’est pas possible en raison du code génétique particulier des mitochondries.
Les expériences d’ordre génétique
La levure est un outil particulièrement intéressant pour l’étude de la biogenèse des mitochondries. En jouant sur le phénomène de répression catabolique par le glucose ou de dérépression, on peut à volonté inhiber ou stimuler la biogenèse des mitochondries. De plus, il est aisé d’obtenir des mutants mitochondriaux ou nucléaires. Dans tous les cas, on peut isoler les mitochondries et suivre l’apparition ou la disparition de la cytochrome oxydase par spectrophotométrie (pic d’absorption spécifique à 603 nm).
Des tests de complémentation ou de ségrégation méiotique ou mitotique permettent de faire la discrimination entre mutants mitochondriaux et mutants nucléaires.
Les mutants mitochondriaux
Vers les années 1946-1948, Boris Ephrussi devait démontrer qu’une culture de levures diploïdes ou haploïdes donne naissance à de petites colonies. La mutation est irréversible. Ces mutants ont perdu la capacité de synthétiser certaines enzymes respiratoires dont la cytochrome oxydase. Ils ont toujours de l’ADN mitochondrial constitué de séquences répétées ne codant pas pour les protéines mitoribosomales. Ces mutants «petite colonie» sont dénommés 福-. Il en existe qui ont perdu totalement leur ADN mitochondrial, ils sont dits mutants 福0.
De nombreux mutants résistant aux antibiotiques ont été identifiés. Ils peuvent concerner des sites d’inhibition très divers: ribosomes (mutants résistant au chloramphénicol par exemple), l’ATP synthétase (mutants résistant à l’oligomycine), le complexe III de la chaîne respiratoire (mutants résistant à l’antimycine).
Des mutations peuvent enfin intervenir dans les gènes qui codent pour les composants indispensables à la synthèse protéique mitochondriale (ARN ribosomaux et de transfert): on a les mutants syn-. Dans le cas où ce sont les gènes codant pour les protéines mitoribosomales qui sont affectés, on a les mutants mit-.
L’utilisation de ces mutants a grandement facilité l’établissement de la carte de loci génétiques de l’ADN mitochondrial de levures (cf. GÉNOME - Le génome mitochondrial) et, notamment, des loci OXI 3, 1 et 2 contenant les gènes pour les sous-unités 1, 2 et 3 de la cytochrome oxydase.
Les mutants nucléaires
Deux groupes de mutants ont été identifiés. Les mutants «petites», qui sont déficients en polypeptides de la chaîne respiratoire ou de l’ATP synthétase, mais qui ont toujours les enzymes catalysant la biosynthèse des porphyrines des cytochromes. Par ailleurs, on a pu identifier des mutants «hem», qui sont déficients en un ou plusieurs enzymes contrôlant la biosynthèse des porphyrines.
La régulation de la synthèse mitoribosomale et cytoribosomale
La concentration de la cytochrome oxydase de levure est un phénomène très bien régulé. La croissance anaérobie, la répression catabolique par le glucose entraînent une perte de mitochondries pleinement différenciées et une perte d’activité cytochrome oxydase. Le phénomène est parfaitement réversible. A priori, deux types de régulation peuvent être envisagés: un effet des produits de la traduction mitochondriale sur la synthèse cytoplasmique des protéines mitochondriales et un effet des produits cytoribosomaux sur la synthèse mitoribosomale.
Il semble, à première vue, que la synthèse mitoribosomale ait peu d’effet sur la synthèse cytoribosomale des protéines mitochondriales. En absence de synthèse mitoribosomale, les protéines synthétisées dans le cytoplasme ne peuvent s’intégrer dans la membrane interne. La synthèse mitoribosomale serait donc seulement essentielle pour l’intégration des polypeptides dans la membrane.
En revanche, des produits cytoribosomaux peuvent exercer un effet sur la synthèse mitoribosomale. Le cytoplasme des cellules contient des éléments qui stimulent la synthèse mitoribosomale. De plus, on a pu montrer que des mutants nucléaires «petites» n’avaient pas de sous-unité 2 ou de sous-unité 3 de la cytochrome oxydase. Des mutations dans le génome nucléaire peuvent donc affecter la synthèse de polypeptides codés par l’ADN mitochondrial.
La synthèse des protéines mitochondriales cytoribosomales et leur transfert dans les mitochondries
La synthèse des polypeptides mitoribosomaux se fait probablement au voisinage de la face matricielle de la membrane interne des mitochondries. Les étapes de cette synthèse sont encore mal connues.
Les étapes de la synthèse des protéines mitochondriales cytoribosomales sont mieux élucidées. On a cru tout d’abord que l’intégration dans les membranes mitochondriales, voire la diffusion des protéines cytoribosomales dans la matrice, étaient un phénomène de type cotraductionnel comme celui démontré pour les membranes du réticulum endoplasmique. En fait, on sait maintenant que la plupart des protéines mitochondriales cytoribosomales (tabl. 4) sont synthétisées sous forme de protéine précurseur dont le poids moléculaire est plus élevé que celui des protéines matures. La protéine précurseur se fixe sur la membrane externe, probablement par l’intermédiaire de récepteur spécifique, puis diffuse dans la membrane interne selon un processus contrôlé par le potentiel électrochimique membranaire. Des enzymes protéolytiques présentes dans la matrice interviennent enfin pour couper une partie de l’extrémité N-terminale de la protéine. Il en résulte un changement de conformation qui facilite la mise en place de la protéine dans son environnement hydrophobe.
Ce processus a été bien étudié dans les mitochondries de levure pour les sous-unités 見, 廓 et 塚 de la composante 1 de l’ATP synthétase, de même que pour les sous-unités 4 à 7 de la cytochrome oxydase. Les protéines de la matrice, comme la carbamyl phosphate synthétase, sont synthétisées et transportées selon un processus identique. Dans certains cas, comme le cytochrome c 1, la maturation se fait en deux étapes. La protéine précurseur (poids moléculaire 37 000) est tout d’abord transformée en protéine intermédiaire (poids moléculaire 35 000) sous l’action d’une protéase matricielle. Puis, une seconde coupure intervient du côté de la face matricielle pour transformer la protéine intermédiaire en cytochrome c 1 (poids moléculaire 31 500). Cette seconde étape est catalysée par une autre protéase et exige que le noyau hémique soit fixé covalemment sur la protéine intermédiaire.
Mitochondries d’origine végétale et phénomène de stérilité mâle cytoplasmique
La levure est un outil de première importance pour l’étude de la biogenèse des mitochondries. Une mutation mitochondriale n’entraîne pas la mort de la cellule qui peut survivre en synthétisant de l’ATP au travers d’un métabolisme fermentaire. Dans les autres cellules, les mutations mitochondriales sont léthales. Une seule exception, une mutation cytoplasmique héréditaire chez le maïs se traduisant par une stérilité mâle: il n’y a pas production de pollen fonctionnel. Ces souches stériles sont importantes sur le plan économique. Il existe, en effet, des plantes qui ont un gène restaurateur nucléaire et qui peuvent supprimer le phénotype mâle stérile. On obtient ainsi des hybrides 1 qui sont plus productifs, qui ont une valeur nutritionnelle et une résistance aux maladies plus élevées que celles des parents. Les mitochondries sont directement impliquées dans ce phénomène de stérilité mâle.
Dans les souches mâles stériles de type Texas, on a pu déceler une sensibilité à une toxine produite par un champignon. Ce déterminant génétique est porté par les mitochondries. L’analyse des segments de restriction des ADN mitochondriaux des souches stériles et des souches normales montre des différences. Les mitochondries isolées de souches stériles sont particulièrement sensibles à la toxine. Elles sont découplées et présentent une grande perméabilité au NAD. Par incorporation de méthionine-35S, on a démontré qu’un polypeptide A (poids moléculaire 21 000) n’était pas synthétisé dans les mitochondries de souche stérile; un polypeptide B de poids moléculaire plus faible (13 000) apparaît. Les mitochondries isolées des hybrides, où un gène restaurateur nucléaire a été utilisé, montrent que la biogenèse du polypeptide A est rétablie et celle de B supprimée. Ce résultat montre bien le contrôle du génome nucléaire sur l’expression du génome mitochondrial.
Encyclopédie Universelle. 2012.