AUXINES
Les auxines sont des régulateurs de croissance qui, chez les plantes supérieures, sont synthétisés principalement dans les bourgeons. Elles contrôlent la croissance des cellules dérivées des méristèmes primaires et la multiplication des cellules des méristèmes secondaires; de plus, leur action est capitale dans certains phénomènes liés à la croissance (tropismes, dominance apicale, parthénocarpie), à l’organogenèse et à la différenciation cellulaire (formation des racines et des bourgeons).
En très faible concentration dans les tissus (6 猪g par kg de bourgeons), elles migrent dans un sens préférentiel (transport polarisé) depuis leur lieu de synthèse jusqu’à leur lieu d’action. Elles sont les plus répandues et les mieux connues des hormones végétales.
Bien que l’on ait tendance à parler «des auxines», en réalité l’acide 廓-indolylacétique (AIA) est la seule substance naturelle dont le rôle hormonal ait été démontré. D’autres substances naturelles présentent une activité auxinique, mais plus faible que celle de l’AIA; il s’agit, pour la plupart d’entre elles, de ses précurseurs.
D’autre part, les chimistes ont synthétisé de nombreuses substances à haute activité biologique auxquelles on a attribué le nom d’auxines synthétiques.
1. Étude physiologique
Découverte
Toutes les connaissances accumulées sur les auxines prennent leur source dans les expériences fondamentales de Darwin sur le phototropisme des coléoptiles d’avoine. De tels organes, soumis à un éclairement unilatéral, se courbent dans la direction de la source lumineuse. Darwin, dès 1880, montre que le sommet de coléoptile perçoit la lumière, mais que le lieu de la réaction (région de la courbure) est situé plus bas. Il conclut qu’une substance chimique doit transmettre l’effet de la lumière aux parties sous-jacentes.
Les recherches entreprises entre 1905 et 1925 par Fitting, Boysen-Jensen, Paàl et Söding précisent que la décapitation du coléoptile empêche toute croissance, et que le fait de replacer l’extrémité apicale sur le coléoptile sectionné restaure la croissance, même si l’on intercale une couche de gélose. Ces résultats ont conduit F. Went à mettre au point le test Avena, qui permet le dosage biologique de cette substance (fig. 1) qu’il nomme auxine (du grec auxè , la croissance).
En utilisant cette technique de dosage, Kögl et ses collaborateurs isolaient, à partir d’urine humaine, diverses substances dont l’une, l’acide 廓-indolylacétique (ou acide indole-3-acétique), fut identifiée, après quelques errements, à l’auxine naturelle, et reconnue depuis comme une hormone présente chez tous les végétaux. Elle peut être extraite aisément et dosée par des méthodes biologiques ou chimiques.
Extraction et dosage
Les dosages sont précédés d’une série de manipulations qui sont dans l’ordre: 1. «fixation» des tissus de façon à arrêter toute activité enzymatique; 2. extraction par un solvant (éther, éthylacétate ou méthanol); 3. séparation des diverses auxines naturelles par passage de l’extrait sur des résines échangeuses d’ions et par chromatographie.
Certains dosages biologiques sont fondés sur l’incurvation d’un organe en présence d’auxine dans le milieu. Tel est le cas du test Avena (fig. 1) et également du test Pisum (fig. 2). Ce dernier ne peut pas être utilisé pour le dosage des auxines naturelles parce que les tissus du pois sont très riches en AIA-oxydases. Par contre, il sert au dosage des auxines synthétiques qui, normalement, ne sont pas transmissibles de cellule à cellule: seules réagissent les cellules en contact avec le milieu.
D’autres dosages biologiques plus utilisés font appel à une mesure d’allongement de fragments de coléoptiles ou de mésocotyles.
De tels dosages ont longtemps été préférés, malgré leur lenteur, aux méthodes chimiques, moins précises et moins spécifiques. Par exemple, le test de Salkowski (coloration rose pâle avec FeCi3) est 100 fois moins sensible que le test de Went (qui permet de déceler jusqu’à 10-8 g/ml-1 d’AIA), et il réagit à tous les composés à noyau indole. Mais les méthodes modernes d’analyse (chromatographie en phase gazeuse ou sur couche mince, spectrophotométrie de masse, spectrofluorométrie, etc.) permettent maintenant d’atteindre des sensibilités du même ordre que les tests biologiques.
Rapport entre la structure et l’activité
De multiples recherches se sont poursuivies à partir de 1950 pour déceler les rapports pouvant exister entre la structure chimique et l’activité des nombreux composés qui, tels les acides indole-butyrique, naphtalène-acétique, 2,4-dichlorophénoxyacétique (2,4-D), ont les propriétés physiologiques de l’auxine (substances auxinomimétiques) et sont utilisés au laboratoire et au champ comme hormones de synthèse. Des règles générales, valables dans la plupart des cas, ont été dégagées: nécessité de la présence d’un noyau non saturé (avec ou sans N), d’une chaîne latérale à groupement acide (ou dérivé) qui ne soit ni trop longue ni trop courte (optimum 2 C), pas trop encombrée (l’acide indole-3-isobutyrique est inactif), le noyau présentant un H libre en position ortho par rapport à la chaîne.
Ces considérations ont amené J. Bonner (1950) et d’autres à suggérer que l’auxine agirait en se fixant par deux points d’attache sur des récepteurs spécifiques, la liaison se faisant par le H du noyau et par le carboxyle. Cette conception a l’avantage de rendre compte de la multiplicité des effets de l’auxine (qui varieraient selon le récepteur) et des antagonismes entre l’auxine et certaines substances voisines, lesquelles s’attacheraient par un pôle au récepteur et empêcheraient ainsi l’auxine de s’y fixer (antagonisme compétitif).
Mais pour tenir compte des nombreuses exceptions aux règles précédentes (ainsi, l’acide trichlorobenzoïque, à la chaîne très courte, est actif, comme est actif l’acide carboxyméthyl-diméthyl-dithiocarbamique (H3C)2N 漣C(S) 漣CH2COOH, pourtant sans noyau). Porter et Thimann (1969) ont amendé la théorie en suggérant que les liaisons seraient électrostatiques entre les deux pôles d’une molécule dipolaire distants de 55 nanomètres (fig. 3). Des considérations sur la structure électronique de composés auxinomimétiques (Ricard et coll., depuis 1953) ont appuyé cette hypothèse.
Synthèse et destruction
L’AIA est en faible concentration dans les cellules et subit un constant turn-over , ce qui suppose une synthèse et une destruction actives.
Les travaux de Thimann sur les cultures de Rhizopus ont permis de montrer que le tryptophane est la substance mère de l’AIA. En effet, ces bactéries cultivées in vitro synthétisent l’AIA uniquement si le milieu contient du tryptophane.
On a, d’autre part, isolé des végétaux nombre de substances (fig. 4) soit acides (ex.: acide indolylpyruvique), soit neutres ou basiques (indolacétonitrile, tryptamine), à activité auxinique, qui pourraient être des intermédiaires entre le tryptophane et l’AIA.
Dans le cas du coléoptile d’avoine, le centre producteur d’AIA est constitué par l’ensemble des petites cellules qui forment le sommet de l’organe. Si cette partie apicale est décapitée, la croissance s’arrête, puis reprend au bout de quelques heures; les cellules sous-apicales assurent la synthèse de l’AIA, c’est la régénération physiologique du sommet . L’AIA serait produit à partir de précurseurs provenant de l’albumen de caryopse.
Chez les plantes herbacées, le bourgeon terminal et les bourgeons axillaires non inhibés sont les centres producteurs, les précurseurs étant issus des feuilles. Chez les plantes ligneuses, l’AIA est synthétisé dans les bourgeons au printemps, à la reprise de la croissance; plus tard, la production d’AIA est également réalisée loin du bourgeon terminal, généralement dans les entre-nœuds où le cambium entre en activité. D’autres organes comme les ovaires, après fécondation, sont aussi le lieu de synthèse de l’AIA.
La croissance des tissus en culture in vitro suggère que l’aptitude à synthétiser l’AIA varie suivant les tissus. En règle générale, la présence d’AIA est indispensable à la prolifération des tissus in vitro . Cependant, les tissus de chou-rave ou les tissus tumoraux (crown-gall) et anergiés (tissus traités par une forte dose d’AIA et repiqués sur milieu sans AIA) prolifèrent très bien en absence d’auxine. On peut alors montrer qu’ils la synthétisent.
L’AIA subit une destruction enzymatique par les AIA-oxydases, qui appartiennent à la classe des peroxydases, enzymes constituées d’une protéine et d’un groupement prosthétique porphyrique à base de fer (comme dans l’hémoglobine). L’oxygène se fixerait sur le fer (ferreux: face=F0019 漣 Fe++) de la peroxydase, donnant ainsi un composé où le fer est passé sous forme ferrique (face=F0019 漣 Fe+++), l’oxygène étant sous forme ionisée (face=F0019 漣 O 漣 -) particulièrement réactive. Ce composé s’unirait à l’AIA; l’ensemble perdrait C2 et H2O d’où finalement:
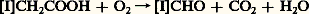
( étant le noyau indole). Des dégradations analogues interviendraient sur le noyau.
Cette dégradation évite les doses excessives d’auxine dans les lieux où elle est transportée (racines par exemple).
Migration
L’auxine émise par les bourgeons migre par le phloème vers les autres parties de la plante. Des études effectuées sur des fragments d’organe isolés à l’aide d’AIA marqué au 14C ont démontré que cette migration était polarisée, s’effectuant mieux dans un sens (du bourgeon vers la racine) que dans l’autre. Ce transport est supprimé par l’absence d’2 ou la présence d’inhibiteurs métaboliques et ne peut être assimilé à une simple diffusion.
Sur le mécanisme de ce transport actif de l’auxine, on en est réduit à des hypothèses; l’une d’elles (Rubery et Sheldrake, 1975; Raven, 1975) repose sur l’intervention des différences de potentiels transmembranaires et des gradients de pH le long de l’axe de l’organe: l’AIA traverse beaucoup plus facilement les membranes sous forme anionique AIA- que sous forme neutre, ce qui explique l’importance des ddp (qui créent un champ électrique) et du pH (son élévation facilite l’ionisation) dans le transport.
De nombreuses substances, qui ne sont pas de nature auxinique, modifient l’activité de cette enzyme. Il en est ainsi des orthodiphénols (acide caféique), des polyphénols (acide gallique), des flavonols et des anthocyanes qui inhibent l’AIA-oxydase; cependant, les monophénols (acides [i]p -coumarique) et les métadiphénols jouent le rôle d’activateurs. Il est possible que ces substances agissent comme effecteurs allostériques.
Il semble bien que l’AIA lui-même contrôle l’activité de l’AIA oxydase; il s’agirait donc d’une enzyme inductible.
Selon Galston, l’AIA-oxydase serait un complexe constitué par une flavoprotéine et une peroxydase. L’AIA, en présence de péroxyde (H22), donnerait sous l’action de la peroxydase un produit de décomposition P1 et de l’eau; P1 serait oxydé par la flavoprotéine avec formation d’eau oxygénée qui servirait à la première étape de la destruction de l’AIA.
2. Rôles de l’AIA
Influence sur la croissance
Stimulation de la croissance des cellules qui appartiennent à des tissus primaires
C’est une action primordiale qui peut se manifester par une croissance de la cellule dans toutes les dimensions (croissance isodiamétrique), ce qui se produit dans les tubercules et les rhizomes. Cependant, la cellule, en présence d’AIA, peut croître uniquement suivant un axe privilégié parallèle à l’axe principal de l’organe (élongation cellulaire). C’est ce que l’on observe dans les tiges des Dicotylédones, les gaines foliaires, les pétioles, les coléoptiles et les feuilles de Monocotylédones.
L’AIA agit à faibles concentrations: environ 10-5 g/ml pour les tiges (fig. 5). Si la concentration est trop élevée, l’AIA produit une hypertrophie des cellules accompagnée d’hyperhydricité (teneur en eau trop élevée et gélification des membranes). Il en résulte une séparation et un isolement des cellules.
L’élongation des racines est inhibée par l’AIA même à de faibles concentrations. Selon certains auteurs, en utilisant des solutions de 10-10 g/ml, il est possible d’obtenir une stimulation de la croissance (fig. 5).
Stimulation de la multiplication cellulaire
L’AIA est également un facteur de la multiplication cellulaire, mais surtout dans le cas des méristèmes secondaires. Snow (1935) a montré que l’AIA stimulait l’activité cambiale. Ce résultat a été confirmé par Avery et Soding (1937), qui ont précisé que, dans un arbre, l’activité du cambium était induite au début du printemps par l’AIA provenant des bourgeons; ensuite l’AIA est synthétisé au niveau du cambium.
D’autre part, l’ablation des bourgeons (centres producteurs d’AIA) sur une jeune plantule provoque un arrêt de la croissance en épaisseur ainsi que de la formation des tissus libéro-ligneux. En disposant au sommet de la plantule, à la place du bourgeon sectionné, un cube de gélose contenant de l’AIA, on rétablit la formation des tissus secondaires (travaux de Snow).
Influence sur les processus liés à la croissance
Action sur les mouvements des végétaux
Le phototropisme, processus auquel nous avons déjà fait allusion à propos de la découverte des auxines, serait dû à une répartition inégale de l’AIA dans les organes exposés à un éclairement unilatéral.
Lorsqu’un organe en voie de croissance est placé en position horizontale, il se redresse s’il s’agit d’une tige (géotropisme négatif); par contre, une racine se recourbera vers la terre (géotropisme positif). Ces mouvements pourraient s’expliquer par action de l’AIA. En effet, dans un organe couché, les parties supérieure et inférieure renferment respectivement 35 et 65 p. 100 de l’AIA total. L’auxine, en stimulant la croissance des tiges, provoque une élongation plus grande de la partie inférieure d’où son géotropisme négatif. Au contraire, l’AIA inhibe la croissance des racines: l’inhibition de l’allongement de leur partie inférieure sera plus forte que celle de la partie supérieure, d’où l’inclinaison de l’organe vers le bas.
Rôle dans la chute des feuilles et des fruits
La plupart de nos arbres dits feuillus perdent leurs feuilles chaque année (feuillage caduc). Cette chute des feuilles est due à l’entrée en activité, lorsque les jours raccourcissent, d’une zone d’abscission ou zone génératrice, située au niveau des pétioles. Les cellules qui en dérivent se subérifient: aussi, au moindre mouvement de l’air, les feuilles tombent.
Une pulvérisation d’auxine sur le pétiole retarde la formation de cette zone d’abscission. Une diminution de la teneur en AIA endogène se produit à la suite du raccourcissement des jours. La séquence serait donc la suivante: raccourcissement des joursdiminution du taux d’AIA endogèneformation et entrée en activité de la zone d’abscissionchute des feuilles. Sur certains arbres de nos villes, on constate bien l’influence de l’éclairement sur la chute des feuilles: les branches placées près de l’éclairage public sont plus tardivement défoliées que les autres (fig. 6).
Toutefois on considère maintenant que l’auxine n’est pas seule en cause et que la chute des feuilles provient tout autant d’une montée du taux de l’éthylène dans les feuilles sénescentes (l’éthylène stimule les cellulases et protéases qui désagrègent la couche d’abscission) que de la baisse de la teneur en auxine.
La formation d’une zone d’abscission cause également la chute des fruits.
Rôle dans les corrélations de croissance
Chez beaucoup de plantes, la croissance des bourgeons axillaires est inhibée par le bourgeon terminal (phénomène de la dominance apicale). Une multitude de facteurs, dont l’AIA, paraissent être à l’origine de ces corrélations. En effet, la décapitation du bourgeon terminal provoque la croissance des bourgeons axillaires. Cependant, si un tube de gélose contenant de l’AIA est placé sur l’extrémité sectionnée de la tige, les bourgeons axillaires demeurent inhibés.
Rôle dans la parthénocarpie
On appelle ainsi la formation de fruits sans fécondation. Le traitement par l’AIA permet d’obtenir des fruits de tomate sans graines (Gustafson, 1963). Mais l’expérience la plus séduisante a été réalisée par Nitsch sur un faux fruit, la fraise. La suppression des akènes chez une toute jeune fraise arrête la croissance du réceptacle charnu. Cette croissance peut être rétablie par une application d’AIA (fig. 7).
Influence sur l’organogenèse
L’apparition des racines sur un organe qui n’en produit normalement pas (rhizogenèse) est contrôlée par de nombreux facteurs dont l’AIAé des boutures plongées dans des solutions assez concentrées en auxines (10-7 à 10-5 g/ml) forment de nombreuses racines.
La différenciation sexuelle est également soumise à l’influence de l’AIA: des bourgeons, dont la destinée est de donner des fleurs mâles, prélevés sur de jeunes plantes de concombre et repiqués sur un milieu de culture contenant de l’auxine, donnent naissance à des fleurs femelles (travaux de Lang).
3. Mode d’action de l’AIA
Les données obtenues sont encore très fragmentaires et portent essentiellement sur l’action de l’auxine dans l’élongation cellulaire. Cette action paraît se situer à deux niveaux: augmentation de la plasticité de la paroi, stimulation de la synthèse de certaines enzymes par action sur les acides nucléiques qui en codent la synthèse.
L’auxine augmente la plasticité de la paroi, comme l’a montré Heyn en 1931: des coléoptiles placés horizontalement se courbent plus facilement sous l’effet d’une surcharge s’ils ont été préalablement traités par l’AIA. Ce qui est en accord avec le fait que l’AIA favorise l’entrée de l’eau (Thimann, 1952). Or la paroi est constituée de microfibrilles de cellulose associées à des chaînes d’hémicelluloses, à un ciment pectique et à des protéines (extensine) par des liaisons acidolabiles. Comme l’action de l’auxine s’accompagne d’une baisse du pH au voisinage de la paroi, on a tendance à admettre que l’auxine se fixerait sur le plasmalemme (membrane plasmique entourant le cytoplasme) et stimulerait les pompes à protons dont celui-ci est muni. Cela ferait régresser les pôles acidoïdes des composés pariétaux, relâcher les liaisons entre ces composés et augmenter la plasticité de la paroi, qui se distendrait sous l’effet de la turgescence interne. Des injections de composés venus du cytoplasme (intussusception) viendraient combler les lacunes du réseau pariétal distendu et redonner de la solidité à la paroi expansée.
Un deuxième effet de l’auxine qui peut expliquer son rôle dans la deuxième phase de l’élongation est la stimulation de la synthèse des protéines et des ARN (acides ribonucléiques), comme l’ont montré les travaux de Nóoden et Thimann (1965), que l’on peut ainsi résumer: l’élongation cellulaire induite par l’AIA est toujours accompagnée d’une augmentation de la synthèse des ARN et des protéines, ces deux processus étant inhibés par les analogues de l’uracile et d’acides aminés (p-fluorophénylalanine, éthionine) et par les inhibiteurs spécifiques de la synthèse des protéines (actinomycine D, puromycine).
Cette stimulation de la synthèse des ARN par l’AIA fut confirmée par l’emploi d’uracile marquée au 14C (Masuda et coll., 1968). Théoriquement l’AIA, comme toute hormone, peut agir au niveau de la formation de mARN, ou au niveau des ribosomes, ou encore comme effecteur allostérique de certaines enzymes. D’ailleurs Sudï a suggéré jadis que les sites allostériques de nombreuses protéines à fonctions différentes pourraient être des sites récepteurs de l’AIA, ce qui expliquerait la multiplicité des phénomènes observés après action de l’AIA.
De toute manière, on connaît au moins un exemple où l’AIA semble bien agir au niveau de la synthèse des mARN: il s’agit de la formation du complexe AIA-aspartate, processus qui n’a pas de lien direct avec la croissance. La synthèse de l’enzyme nécessaire à la formation de ce complexe est induite par l’AIA et inhibée par l’actinomycine D.
En admettant que l’augmentation de la plasticité membranaire soit le fait fondamental qui détermine la croissance, on ne connaît pas la nature des enzymes activées ou synthétisées par l’AIA, bien que l’on ait pensé à des enzymes cellulolytiques.
L’auxine stimule aussi la synthèse de diverses enzymes (cellulases, peroxydases), ce qui implique aussi une intervention au niveau des acides nucléiques.
D’autres travaux (en particulier de J. Ricard et de ses élèves, à Marseille) ont suggéré que l’auxine agirait sur la transcription (synthèse des mARN, acides ribonucléiques, qui vont porter l’information contenue sur les ADN aux ribosomes, lieu de synthèse des protéines). Elle (ou le complexe qu’elle forme avec un récepteur) relâcherait les liaisons entre les brins d’ADN et les histones qui les enrobent. Cela faciliterait l’accès, à ces brins, des enzymes (polymérases) permettant la synthèse des mARN. L’auxine pourrait peut-être aussi stimuler en un deuxième temps la synthèse de ces polymérases elles-mêmes (fig. 8).
On ignore encore tout des mécanismes des autres actions de l’auxine, mais il se pourrait que les deux processus évoqués plus haut y jouent leur rôle: modification des perméabilités membranaires par le jeu de pompes à protons, dérépression des ADN facilitant la transcription du code génétique.
4. Auxine et autres régulateurs de croissance
L’action de l’auxine ne peut être dissociée intégralement de celles des autres régulateurs de croissance qui bien souvent la complètent ou la modifient.
Nous avons vu plus haut que la chute des feuilles résulte d’une modification de l’équilibre auxine-éthylène. L’éthylène, qui se synthétise dans les organes sénescents, a tendance à ralentir la migration de l’auxine. Au contraire, l’auxine stimule la production d’éthylène, et peut-être l’inhibition du développement des bourgeons (dominance apicale) relève-t-elle de ce mécanisme.
L’acide abscissique (ABA) est un autre inhibiteur du développement des bourgeons et de la croissance de certains organes, dont l’action est renforcée par la présence de l’auxine: le géotropisme négatif d’une racine horizontale serait dû tout autant à l’excès d’ABA sur la face inférieure (il est sécrété par la coiffe de la racine) qu’à l’effet direct de l’excès d’auxine (Pilet, 1977).
Les gibbérellines ont un rôle généralement complémentaire de l’AIA sur la croissance (elles stimulent le déboîtement des entre-nœuds et des méristèmes intercalaires, alors que l’AIA agit sur la zone subapicale des rameaux et sur les cambiums) et la morphogenèse (elles lèvent l’inhibition des bourgeons induite par l’AIA) et présentent souvent des interactions complexes avec l’AIA dans la synthèse des enzymes.
Mais l’interaction la plus spectaculaire est celle entre les cytokinines et les auxines, dont l’action conjointe et équilibrée est nécessaire pour les divisions cellulaires et les différenciations d’organes.
En définitive, le rôle fondamental de l’AIA dans le développement végétal s’inscrit dans le cadre plus général d’un équilibre hormonal, qui doit être respecté entre les différents régulateurs.
5. Applications pratiques
Le mode d’application des auxines dépend de la nature de la substance utilisée et du processus physiologique que l’on veut induire ou inhiber.
Le plus souvent les auxines sont mises en solution. Si le solvant est l’eau, il est préférable d’utiliser un sel d’AIA, l’acide étant peu soluble. On peut également dissoudre les auxines dans de l’alcool ou dans les solvants qui diminuent les phénomènes de tension superficielle, facilitant ainsi la pénétration (tween). Pour certains traitements, pour le désherbage ou le bouturage, on peut incorporer l’auxine à de la lanoline tiède; on obtient ainsi une pâte qui est applicable aisément sur les plantes. Il est également possible d’administrer l’auxine par aérosols; il suffit de la dissoudre dans un solvant qui s’évapore aisément, ou, encore, de préparer des esters méthyliques des auxines, qui sont très volatils.
Les auxines sont utilisées comme désherbant pour éliminer les mauvaises herbes des champs de céréales et des prairies, car les Dicotylédones adventices sont plus sensibles aux auxines que les Monocotylédones.
Cette utilisation nécessite beaucoup de précautions: la dose, la nature et le mode d’application de l’auxine dépendent de la plante qu’on veut éliminer, de la nature du sol, de l’époque où le traitement est réalisé et des cultures qui environnent le champ traité. Les dérivés phénoxyacétique, phénoxybutyrique et phénoxypropionique sont les plus employés.
En solution ou incorporés à une pâte de lanoline, ces auxines activent la rhizogenèse, permettant ainsi une meilleure «reprise des boutures».
À concentration relativement élevée, elles inhibent la croissance des bourgeons et les maintiennent en dormance. Cet effet a reçu une application dans la conservation des pommes de terre (inhibition de l’allongement des germes).
Les auxines sont employées pour améliorer la croissance des fruits sans «pépins», pour accélérer la maturation des fruits ou pour retarder leur chute. D’autre part, de nombreux arbres fruitiers ne produisent abondamment qu’une année sur deux, mais on peut améliorer le rendement au cours de l’année favorable en supprimant la production de fruits l’année précédente, ce qui est réalisé en brûlant les pistils par traitement au 2,4 D (acide 2,4-dichlorophénoxyacétique) ou à l’ANA (acide naphtylacétique).
L’importance des auxines dans l’horticulture et l’agriculture apparaîtra évidente si l’on songe que la production d’auxines synthétiques se monte à 45 000 tonnes par an aux États-Unis.
Encyclopédie Universelle. 2012.