CYTOLOGIE
La cytologie est née lorsque la notion de la cellule, élément fondamental des organismes vivants, fut établie définitivement, c’est-à-dire vers 1840.
Cette conception fondamentale était l’aboutissement des travaux des micrographes de jadis, dont le Hollandais Leeuwenhoek (1632-1723) qui apprit aux naturalistes que, au-delà des choses immédiatement visibles, il existait un immense et étonnant domaine que révélaient les verres grossissants, en particulier cette loupe primitive qu’il fabriquait lui-même avec des gouttes de verre fondu. Puis, à la loupe succéda le microscope composé. Les grossissements furent plus forts, mais au prix de déformations des images qui rendirent suspects à beaucoup les résultats obtenus; ils permirent cependant de constater la présence, dans quantité d’objets, de petites cavités, ou cellulae . Toutefois, l’emploi du microscope caractérisait plus une technique générale, la micrographie, qu’un chapitre de la biologie.
Avec les progrès de l’optique et, en particulier, après la découverte des lentilles achromatiques, naquit avec Schleiden, Schwann et Dutrochet cette idée fondamentale que la cellule est l’unité de structure de tous les êtres vivants.
Le XIXe siècle s’est alors distingué par la description très minutieuse de tous les types cellulaires; il a su aussi reconnaître, dans la multiplicité des structures révélées par le microscope, des constantes fonctionnelles: la présence et le rôle toujours retrouvés du noyau, des mitochondries, des vacuoles en sont un exemple.
La cytologie est ainsi devenue un des chapitres fondamentaux de la biologie. Elle a donné naissance non seulement aux cytologies animales et végétales, mais aussi à la cytogénétique, à la cytochimie (qui s’occupe de la détection et de l’analyse des matériaux chimiques des cellules), à la cytophysique (qui s’efforce de déterminer et de mesurer les processus physico-chimiques qui commandent le fonctionnement cellulaire), enfin à la cytopathologie en ce qui concerne les réactions des divers types de cellules aux différentes agressions et troubles fonctionnels.
1. L’évolution de la cytologie
L’histoire de la cytologie et de ses techniques se divise en plusieurs périodes.
Dans une première période (de 1840 à 1870 environ), la théorie cellulaire s’étend et se précise. Deux notions fondamentales sont établies: a ) Les cellules proviennent exclusivement d’une cellule antérieure; il n’y a pas de génération spontanée de cellules; la vie est continue. b ) Les cellules sont formées d’un cytoplasme et d’un noyau. Cette période est dominée par l’ouvrage célèbre de Virchow sur le fonctionnement pathologique des cellules (Die Cellularpathologie in ihrer Begründung auf die physiologische und pathologische Gewebelehre , 1858). La technique des coupes minces et des colorations se développe.
La deuxième période (entre 1870 et 1900) correspond à la naissance de la cytologie moderne. On découvre le mécanisme de la division cellulaire, la mitose, et, à partir de là, s’instaure l’embryologie cellulaire. Dans ses Leçons sur les phénomènes de la vie (1878-1885), Claude Bernard jette les bases de la physiologie cellulaire et des rapports entre chimie et morphologie cellulaire. En biologie générale, Metchnikoff découvre la phagocytose. En ce qui concerne les techniques, Ehrlich applique les colorants à base d’aniline à l’étude de la cellule; les travaux d’Abbe sur les objectifs à immersion et apochromatiques perfectionnent l’optique des microscopes.
La troisième période commence avec le XXe siècle; après la redécouverte des lois de Mendel, la cytogénétique naît; dans l’intérieur de la cellule, on met en évidence des organites nouveaux: l’ergastoplasme, les mitochondries, les corps de Golgi. Harrison et Carrel mettent au point les cultures de cellules in vitro . Chambers montre la possibilité d’une microdissection des cellules. Puis, entre 1930 et 1950, les applications des techniques physiques, chimiques et physiologiques se multiplient: études en lumière polarisée, fluorescence, analyse spectroscopique d’émission et d’absorption, spectrophotométrie, utilisation des isotopes radioactifs, techniques cytochimiques, micro-incinérations, etc. En quelques années, des progrès considérables sont faits dans l’ordre de la microscopie morphologique et de la cytophysiologie.
Vers 1945, avec la création et le développement du microscope électronique d’une part, avec l’emploi bien réglé de la technique des centrifugations différentielles d’autre part, apparaît une cytologie moléculaire.
Aux progrès immenses acquis dans les pouvoirs de résolution microscopique (au micromètre succède le nanomètre comme unité de mesure) s’ajoutent les conceptions nouvelles qui caractérisent la cytologie moléculaire. On s’est rendu compte qu’entre les plus fines structures que permet d’observer le microscope électronique et les molécules diverses que révèlent les méthodes biochimiques, il existe une zone intermédiaire, celle des macromolécules et de leurs groupements. Dans cette zone, encore mal connue, se déroulent les processus essentiels du métabolisme, c’est-à-dire de la vie. C’est à la prospection de ce domaine passionnant, où se confondent formes et fonctions, que se consacrent les efforts des cytologistes d’aujourd’hui.
Telle était la situation au milieu du XXe siècle pour la cytologie. Elle annonçait sans ambiguïté l’évolution qu’elle devait accomplir ensuite dans trois directions.
La première concerne la cytologie submoléculaire. Au-delà des molécules s’étend le monde des atomes et des électrons, celui des conceptions quantiques. Il faudra un jour passer du domaine actuel du continu à celui du discontinu, celui des électrons et des autres particules élémentaires. La deuxième direction, plus physiologique, est liée aux connaissances actuelles sur le rôle de l’acide désoxyribonucléique dans la synthèse des protéines, éléments essentiels de la vie. La troisième direction se rapporte à l’étude des populations de cellules. Celles-ci ne vivent pas isolément, mais forment des sociétés coordonnées. Ainsi se développe une sociologie ou écologie cellulaire, qui jouera dans la cytologie le même rôle que l’écologie dans la zoologie générale.
2. Les méthodes en cytophysiologie
Dès la première moitié du XIXe siècle, les cytologistes, convaincus de la présence absolument générale de l’unité cellulaire comme constituant de base de tous les êtres vivants, constatèrent qu’elle récapitulait toutes les activités fondamentales qui caractérisent la vie. Tout comme un être pluricellulaire constitué de tissus, d’organes et d’appareils réalise diverses fonctions, la cellule, si petite soit-elle, est capable à elle seule d’assurer ces mêmes fonctions: nutrition, fonction de relation, croissance, reproduction, fonctions pressenties, reconnues par Schleiden et Schwann dès 1840. À l’unité morphologique ou de structure s’est donc rapidement ajoutée la notion d’unité physiologique.
De nouvelles méthodes d’observation permettent de discerner les replis les plus discrets des nombreuses structures membranaires; elles permettent également d’avoir une vision précise de la structure même de ces membranes, entre lesquelles existent des espaces non structurés où les substances se trouvent en solution. La cellule est donc formée de membranes qui limitent ou séparent des masses aqueuses. Les activités enzymatiques, responsables de toutes les réactions biochimiques, peuvent être localisées soit sur les membranes, soit dans les espaces non structurés.
Bien que la distinction paraisse a priori artificielle, il faut, en cytophysiologie, considérer différemment les cellules qui constituent à elles seules un organisme (les unicellulaires) et les cellules intégrées dans une masse tissulaire faisant elle-même partie d’un des organes d’un organisme pluricellulaire.
En effet, dans le premier cas, la cellule assure intégralement toutes les fonctions vitales dans leur complexité et leur chronologie, ce qui implique une spécialisation très poussée des diverses infrastructures; alors que, dans le second cas, les fonctions d’un organisme sont réparties en différents appareils à tissus spécialisés, les cellules ne présentant qu’une facette des activités vitales. Leur forme, leurs infrastructures, leur équipement enzymatique sont hautement spécialisés, en sorte qu’elles ne réalisent principalement qu’une seule des fonctions vitales. Dans certains cas, on peut isoler et cultiver les cellules d’un tissu (il ne s’agit pas de culture de tissus, mais véritablement de cultures cellulaires): cette expérience présente une difficulté d’autant plus grande que les cellules sont spécialisées; il faut alors fournir à la culture un grand nombre d’éléments (vitamines, hormones, cofacteurs) que les cellules ont perdu le pouvoir de synthétiser. Dans les cas de réussite, on observe une uniformisation des formes et des structures, sans que l’on puisse jamais retrouver les caractéristiques physiologiques des unicellulaires.
Une autre différence entre unicellulaires et cellules de pluricellulaires réside dans la réactivité à l’environnement. Les organismes constitués d’une seule cellule réagissent vigoureusement à toute variation des conditions du milieu au sein duquel elles vivent; au contraire, les cellules constitutives d’un organisme pluricellulaire ont des réactions amorties par le jeu des régulations et corrélations qui s’établissent dans le cadre de l’unité de l’être entier et qui assurent une constance dans les conditions physico-chimiques immédiates des cellules. On parlera alors d’un milieu intérieur qui constitue le véritable environnement des cellules.
Il existe deux méthodes fondamentales pour l’étude de la physiologie cellulaire: l’une consiste à isoler d’une masse cellulaire supposée homogène les constituants moléculaires ou les organites, et à en étudier ensuite les propriétés in vitro ; l’autre consiste à observer les phénomènes et réactions physiologiques in situ . Il est clair qu’aucune de ces deux méthodes ne peut fournir des renseignements complets, et le cytophysiologiste sera toujours obligé d’employer alternativement l’une et l’autre.
L’isolement des enzymes, d’organites ou de parties d’organites fournit des renseignements extrêmement précis sur les particularités métaboliques, mais fort grossiers sur leur localisation. De même, si les observations in situ permettent une description très fine des sites et des structures, elles ne procurent que des informations très approximatives sur les compositions et les fonctions.
Les isolements et études d’activités in vitro
En partant d’une masse cellulaire homogène, on peut pratiquer des extractions plus ou moins sélectives. Après avoir purifié les extraits, on procède à leur analyse. Les méthodes et techniques de la biochimie classique servent à ce type d’expérience. Bien qu’il ne s’agisse pas là de procédés propres à la cytophysiologie, ce mode d’investigation est constamment employé dans les laboratoires de physiologie cellulaire. Toutes les techniques biochimiques sont employées par le physiologiste: utilisation de traceurs radioactifs, purifications et analyses par chromatographie, électrophorèse, spectrophotométrie, etc.
Les méthodes d’isolement d’organites ou de parties d’organites sont plus spécifiques aux recherches cytophysiologiques. Elles ont pour but de séparer du complexe cellulaire une classe d’organites dont on veut analyser les propriétés particulières. On isolera, par exemple, les noyaux ou les mitochondries, ou encore les chloroplastes. Aucune des parties de la cellule n’a échappé à ce genre d’investigation. En plus des organites mentionnés, on isole les ribosomes (du cytoplasme ou des organites eux-mêmes), les filaments du réticulum endoplasmique, les vacuoles, les appareils de Golgi, les fuseaux achromatiques, etc.
Les difficultés que présentent de telles expériences sont considérables. On peut les énumérer et signaler comment on arrive à les résoudre.
Broyage
Pour isoler les éléments du contenu cellulaire, il faut broyer les cellules. Dans le cas des cellules végétales, on se trouve devant la difficulté que présente le fait de casser un cadre rigide sans détériorer le contenu qui cependant est beaucoup plus fragile. Il y a deux façons de résoudre ce problème: soit briser ce cadre avec toute la vigueur nécessaire (broyeur à palettes, éclatement par pression et décompression, mortier et sable, etc.) et ensuite sélectionner les organites qui, par chance, sont restés intacts; soit employer des méthodes plus douces mais moins efficaces et plus lentes (destruction enzymatique du ciment intercellulaire ou du cadre cellulaire).
Le broyage des cellules a pour effet immédiat de mettre en contact des sites qui, à l’état normal, étaient géographiquement séparés et, de ce fait, de favoriser l’action d’enzymes sur des substrats. Pour éviter la formation d’artéfacts moléculaires dus à la réactivité des constituants cellulaires, le broyage et l’isolement se pratiquent dans des laboratoires froids où tous les appareils sont réfrigérés (2 0C).
Fractionnement
Le broyat une fois obtenu, on se trouve en présence d’un mélange de toutes les parties cellulaires en suspension. Pour les fractionner, on utilise essentiellement la force centrifuge. La vitesse de sédimentation V suit la loi de Stokes:

où V désigne la vitesse de sédimentation, (cm . s-1), h la distance parcourue par la particule (cm), t le temps en s pour parcourir h , r le rayon de la particule (cm), g l’accélération de la gravité (980 cm . s-2), 兀 la viscosité du liquide (poises), k le facteur forme de la particule, dp la densité de la particule, et dm la densité du liquide de suspension.
La force centrifuge (F = M 諸2 R) augmente g et les particules cellulaires vont sédimenter plus ou moins vite suivant leur taille et leur densité. Par des centrifugations différentielles, on peut ainsi obtenir des culots successifs qui contiennent préférentiellement (mais non exclusivement) tel ou tel type de particules.
Ce n’est pas tellement la densité des particules qui est à considérer, mais leur densité relative vis-à-vis du milieu de dispersion (dp – dm ).
C’est pourquoi on pratique parfois des isolements en centrifugeant des gradients de densités; les divers organites se stabilisent à des niveaux différents dans les tubes de centrifugation, où on pourra alors les recueillir.
Milieu
Au cours du broyage et du fractionnement, le contenu cellulaire doit être dilué par une solution dont les propriétés osmotiques, le pH et la composition ionique doivent être aussi voisins que possible de ceux du cytoplasme. Toute erreur dans ce domaine a pour effet l’éclatement des organites ou la solubilisation de leur contenu.
Pour éviter la solubilisation du contenu des organites, on choisit parfois délibérément un milieu de dispersion non aqueux (tétrachlorure de carbone, hexane), qui maintient les substances hydrosolubles en place, mais a pour inconvénient de provoquer des formations de structures. C’est le but précis de la recherche qui oriente le choix du milieu d’isolement.
Les observations in situ
Le microscope permet d’observer les formes et les structures cellulaires. Son pouvoir de résolution élevé (200 nm pour le microscope photonique, 0,5 nm pour le microscope électronique) fait de cet appareil l’outil de base de la cytologie. En cytophysiologie, les renseignements qu’il fournit sont de plusieurs natures. Par fixation ou coloration sélective, il est possible d’avoir des renseignements qualitatifs et parfois quantitatifs sur la composition de telle ou telle structure. Ces renseignements sont souvent grossiers, mais la cytochimie pallie son manque de précision biochimique par une grande finesse de localisation. Grâce à des colorants ou réactifs appropriés, on peut, en effet, non seulement connaître approximativement la nature des composés cellulaires, mais aussi la localisation d’activités enzymatiques, le pH, la pression osmotique. La microscopie électronique est d’un faible secours dans ce domaine. Il n’en reste pas moins vrai qu’en faisant varier le mode de fixation, on peut atteindre une certaine connaissance de la composition biochimique des infrastructures.
Grâce à un appareillage d’appoint, le microscope photonique permet de réaliser des opérations sur les cellules: ablations d’organites, mérotomie, greffes. Cette microchirurgie permet d’induire des néomorphoses qui révèlent le rôle morphogénétique des parties de la cellule.
Le microscope électronique, qui permet de mieux connaître l’architecture membranaire, ne révèle que des structures fixées, souvent par des fixateurs violents, et on s’est longtemps demandé si les enseignements qu’il fournissait dans ce domaine ne relevaient pas de la stricte observation d’artéfacts (quand il s’agit, cela s’entend, des structures fines membranaires et non des formes d’organites). Grâce au cryodécapage (freeze-etching ), on peut se passer de la fixation chimique des échantillons. Ceux-ci sont brutalement congelés, puis la masse vitreuse est cassée finement. Les surfaces des structures ainsi dégagées sont recouvertes d’une couche de carbone qui forme réplique et que l’on observe. Ces observations révèlent des architectures membranaires qu’on peut supposer être celles des cellules vivantes (une décongélation lente montrerait que les cellules ne sont pas tuées). La connaissance des architectures membranaires est d’un grand intérêt pour le cytologiste, qui sait le rôle capital que joue l’agencement des membranes dans de nombreux métabolismes (lamelles chloroplastiques, membranes des crêtes mitochondriales, plasmalemme).
On peut suivre l’incorporation et la localisation cellulaire de métabolites par l’utilisation d’isotopes radioactifs. Après absorption, les cellules fixées sont mises en contact avec des plaques ou films qui sont impressionnés. Cette technique, l’histoautoradiographie, est de grande valeur pour le cytologiste qui peut suivre ainsi la pénétration, les éventuelles modifications et la localisation de molécules engagées dans tel ou tel métabolisme.
Toutes ces méthodes, les observations in vitro principalement, exigent souvent une grande quantité de cellules. Il peut s’agir de cultures aseptiques de tissus ou de micro-organismes monocellulaires. On réalise également, mais avec des difficultés plus grandes (cf. Facteurs de croissance in CROISSANCE [Biologie]), des cultures de cellules isolées provenant de tissus désorganisés. La grande quantité de cellules ne représente pas la seule condition. Il faut aussi que les cellules soient toutes au même stade de développement. C’est à cette fin que, à l’aide de rythmes lumineux ou thermiques judicieusement choisis, on réalise des cultures synchrones, c’est-à-dire où toutes les cellules ont le même âge, se divisent au même moment, grandissent ensemble, etc.
cytologie [ sitɔlɔʒi ] n. f.
• 1888; de cyto- et -logie
♦ Partie de la biologie qui étudie la cellule vivante, sous tous ses aspects (structure [⇒ histologie], propriétés, activité, évolution).
● cytologie nom féminin Étude des caractères morphologiques et fonctionnels des cellules.
cytologie
n. f. Didac. Branche de la biologie qui étudie la cellule sous tous ses aspects.
⇒CYTOLOGIE, subst. fém.
BIOL. Science qui a pour objet l'étude de la cellule, normale ou pathologique, et notamment sa morphologie, ses propriétés physiques, chimiques et physiologiques et son évolution. Cytologie animale, végétale :
• ... la grande révolution du XXe siècle réside dans l'invention de la microscopie électronique qui rend possible l'examen des ultrastructures cellulaires et, partant, a entraîné une révision de la cytologie et de l'histologie.
Hist. gén. des sc., t. 3, vol. 2, 1964, p. 663.
SYNT. Cytologie descriptive, expérimentale, statistique; cytologie génétique, céphalo-rachidienne.
Prononc. :[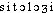 ]. Étymol. et Hist. 1888 (Lar. 19e 2e suppl.). Composé des éléments préf. cyto- et suff -logie. Fréq. abs. littér. :1.
]. Étymol. et Hist. 1888 (Lar. 19e 2e suppl.). Composé des éléments préf. cyto- et suff -logie. Fréq. abs. littér. :1.
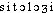 ]. Étymol. et Hist. 1888 (Lar. 19e 2e suppl.). Composé des éléments préf. cyto- et suff -logie. Fréq. abs. littér. :1.
]. Étymol. et Hist. 1888 (Lar. 19e 2e suppl.). Composé des éléments préf. cyto- et suff -logie. Fréq. abs. littér. :1.
cytologie [sitɔlɔʒi] n. f.
ÉTYM. 1890, P. Larousse, Deuxième Suppl.; de cyto-, et -logie.
❖
♦ Didact. (biol.). Partie de la biologie générale qui étudie la cellule vivante sous tous ses aspects (structure, propriétés, activité, évolution). || Cytologie descriptive. || Cytologie expérimentale. || Cytologie statistique.
➪ tableau Noms de sciences et d'activités à caractère scientifique.
❖
DÉR. Cytologique, cytologiste ou cytologue.
Encyclopédie Universelle. 2012.