нарушение ритма сердца, характеризующееся частым и обычно нерегулярным возбуждением волокон миокарда предсердий. а также полной разнородностью сокращений желудочков по частоте и силе, причем продолжительность сердечных циклов значительно колеблется и носит случайный характер. Возбуждение по миокарду предсердий при их мерцании распространяется совершенно неупорядоченно. В экспериментах и во время операций на открытом сердце видно, что во время фибрилляции предсердий на гладкой поверхности их миокарда появляются мерцающие блики, напоминающие водную рябь, что и определило название аритмии. Термин «фибрилляция» (мышечное подергивание) отражает сущность данной аритмии. Сократительная функция предсердий, которые при фибрилляции перестают функционировать как единое целое, полностью утрачивается. В одну группу с М.а. объединяют также трепетание предсердий, при котором возбуждение циркулирует по их миокарду упорядочение, но по необычным путям, а ритм сокращений желудочков сердца периодически может быть правильным. Объединение мерцания и трепетания предсердий в одну группу нарушений ритма основано на сходстве этиологии, патологической физиологии и клинической картины этих двух разновидностей аритмий и на том, что каждая из этих разновидностей очень часто трансформируется в другую. Подобная трансформация может наблюдаться у одного больного на протяжении нескольких лет. Отражение мерцания и трепетания предсердий на ЭКГ несколько различается. При мерцании предсердный зубец Р исчезает и на протяжении всей диастолы регистрируются нерегулярные волны различной, но преимущественно очень небольшой амплитуды с частотой 600—800 в 1 мин; при трепетании предсердий вместо зубца Р регистрируются правильные волны трепетания F (англ. flutter трепетание) с частотой 240—300 в 1 мин, отражающие упорядоченную циркуляцию возбуждения в миокарде предсердий по необычным путям. Проведение импульсов возбуждения на желудочки сердца при мерцании предсердий не имеет хронологической закономерности (имеет значение лишь длительность рефрактерного периода), поэтому желудочки при М.а. сокращаются также беспорядочно (абсолютная, или полная, аритмия). Ритм сокращений желудочков при трепетании предсердий может быть как правильным, если одно сокращение желудочка возникает в ответ на каждое второе, каждое третье или четвертое возбуждение предсердий (в редчайших случаях каждое возбуждение предсердий сопровождается желудочковым ответом), так и неправильным, если желудочковые сокращения возникают в ответ то на два, то на три и т.д. возбуждения предсердий. Обе эти формы являются ассоциированными, т.к. при них прослеживается четкая связь между возбуждением предсердий и желудочков. Подобная связь может отсутствовать, и тогда желудочки сокращаются беспорядочно, как и при мерцании предсердий (диссоциированное трепетание предсердий).
В зависимости от частоты сокращений желудочков сердца выделяют тахисистолическую (более 100 сокращений в 1 мин), эусистолическую (70—100 сокращений в 1 мин) и брадисистолическую (менее 70 сокращений в 1 мин) формы М.а. Это деление весьма условно. Так, считают, что для тахисистолической формы характерен дефицит пульса (Пульсация). Однако и при частоте сердечных сокращений более 100 в 1 мин дефицит пульса выявляется не всегда; он может при одинаковой частоте сердечных сокращений отсутствовать в покое, но возникать при нагрузке. Кроме того, небольшой дефицит пульса возможен также при эусистолической и брадисистолической формах М.а., если неравномерность интервалов между сердечными сокращениями выражена особенно резко. В зависимости от того, протекает ли нарушение сердечного ритма в виде приступов или носит постоянный характер, различают постоянную и пароксизмальную формы М.а. Аритмию, продолжающуюся более десяти дней, принято считать постоянной.
Этиология. М. а, относится к распространенным нарушениям сердечного ритма. Чаще всего она бывает проявлением Кардиосклероза различной этиологии, ревматических митральных пороков сердца. Реже причиной М.а. бывают изменения сердечной мышцы при остром Миокардите, миокардиодистрофии (Миокардиодистрофия), особенно при тиреотоксикозе (см. Зоб диффузный токсический), и некоторых экзогенных интоксикациях (алкоголем, сердечными гликозидами, адреномиметиками и др.), Кардиомиопатии. Инфаркт миокарда осложняется М.а. нечасто. При хроническом легочном сердце М.а. (Лёгочное сердце) иногда развивается в терминальной стадии сердечной недостаточности. Возникновению М.а. наряду с поражениями миокарда в той или иной мере способствуют нарушения внутрисердечной гемодинамики. Нередко самое тщательное исследование не выявляет даже предположительной причины М.а.; в подобных случаях говорят о ее идиопатической форме. Существование чисто нейрогенных форм М.а. сомнительно, хотя нервно-психические перегрузки могут провоцировать ее возникновение.
Патогенез. Подавляющее большинство исследователей считают, что в основе патогенеза М.а. лежит так называемый механизм повторного входа возбуждения в миокард (reentry). Сущность этого механизма — возникновение предпосылок для повторного входа возбуждения в те волокна миокарда, из которых оно пришло, причем повторный вход возбуждения происходит по другим путям, чем первоначальный. Различают механизмы micro-reentry — циркуляцию возбуждения на уровне волокон Пуркинье, с которой связано, в частности, мерцание предсердий (рис. 1), и macro-reentry, когда возбуждение циркулирует по проводящим путям, что наблюдается, например, при трепетании предсердий (рис. 2). Как видно на рис. 1, необходимым условием повторного входа возбуждения в миокардиальные волокна является наличие в них участка с нарушенной проводимостью. Мерцание предсердий запускается предсердной экстрасистолой (см. Экстрасистолия), если она возникает в период относительной рефрактерности предсердий, т. е. когда после предшествующего нормального сокращения предсердий не во всех их волокнах полностью восстановилась возбудимость и имеется мозаичность функционального состояния миокарда предсердий. Значение механизма reentry в генезе мерцательной аритмии доказано электрофизиологическими исследованиями. Нерегулярность сокращений желудочков при М.а. связана с особыми свойствами атриовентрикулярного узла. Электрофизиологические и биомеханические характеристики миокарда подчиняются закону «все или ничего». Иными словами, подпороговый импульс не вызывает возбуждения миокарда, а интенсивность возбуждения и сила сокращения миокарда не зависят от величины надпорогового импульса. В противоположность этому способность атриовентрикулярного узла проводить импульсы возбуждения из предсердий в желудочки прямо зависит от силы этих импульсов: слабые импульсы «угасают» при движении по узлу (так называемый декремент проведения). Поэтому при мерцании предсердий в желудочки проникают только наиболее сильные из многочисленных нерегулярных импульсов, поступающих в атриовентрикулярный узел из предсердий. Реализации механизма повторного входа возбуждения в миокард способствуют некоторые нарушения баланса электролитов, в частности пониженная концентрация ионов калия в клетках миокарда (гипокалигистия).
Клиническая картина. Проявления М.а. зависят от ее формы (тахисистолическая или брадисистолическая, постоянная или пароксизмальная), от состояния клапанного аппарата сердца, миокарда предсердий и желудочков, наличия или отсутствия аномальных проводящих путей между предсердиями и желудочками и, наконец, от индивидуальных психических особенностей больного. В общем больные значительно хуже переносят тахисистолическую форму М.а., чем эусистолическую или брадисистолическую, если только брадикардия не достигает крайней степени. Иногда (чаще всего при пороках сердца) сразу устанавливается постоянная форма М.а., но обычно М.а. сначала имеет приступообразный характер, причем темп прогрессирования приступов (их частота, продолжительность) крайне различен: так, если у одного больного после двух-трех пароксизмов устанавливается постоянная форма М.а., то у другого в течение всей жизни могут отмечаться лишь редкие (один раз в несколько лет) и непродолжительные приступы, не имеющие тенденции к прогрессированию. В ряде случаев на протяжении многих лет отмечаются лишь непродолжительные (несколько секунд) редкие «пробежки» мерцательной аритмии.
Момент возникновения М.а. больные ощущают по-разному. Некоторые вообще не замечают М.а. и о ее наличии узнают только от врача, обращаясь к тому по какому-либо иному поводу. В других случаях появление М.а. сопровождается неопределенными неприятными ощущениями в области сердца, чувством нехватки воздуха. Однако чаще всего М.а. воспринимается как резкое хаотическое сердцебиение (при правильной форме трепетания предсердий сердцебиение ощущается как частое, но ритмичное), сопровождающееся слабостью, потливостью, нередко страхом, похолоданием конечностей, дрожью, полиурией. Если частота сердечных сокращений очень велика (а при наличии между предсердиями и желудочками аномальных проводящих путей она может достигать 200 и даже 300 в 1 мин), наблюдаются головокружение, полуобморочное состояние, обморок и даже развернутый приступ Морганьи — Адамса — Стокса (см. Морганьи — Адамса — Стокса синдром). Описанные симптомы исчезают почти сразу после восстановления синусового ритма или постепенно уменьшаются под влиянием адекватного лечения. Со временем большинство больных с постоянной формой М.а. перестают ее замечать. При пароксизмальной форме возникновение приступа М.а. часто сопровождается симптомами вегетативного адренергического криза (выраженная тахикардия, дрожание, страх, полиурия и др.), которые со временем (при возникновении последующих пароксизмов) становятся менее выраженными.
Объективное исследование при М.а. выявляет полную неупорядоченность пульса и сердечных сокращений. Пульсовые удары следуют один за другим через неодинаковые промежутки времени, которые у одного и того же больного иногда могут различаться в несколько раз. Наполнение, напряжение и скорость пульса меняются от удара к удару. Очень редко пульс при кратковременной пальпации кажется ритмичным. Непостоянна и громкость тонов сердца: чем короче диастола, тем громче следующий за ней первый тон. Часто, особенно при тахисистолической форме мерцания предсердий, выявляется дефицит пульса. Повторные измерения АД обнаруживают непостоянство систолического давления. При ассоциированной форме трепетания предсердий отмечается определенная ритмичность сердечных сокращений, частота которых при правильной форме трепетания предсердий при проведении каждого второго импульса составляет 120—150 в 1 мин, при проведении каждого третьего импульса — 80—100 в 1 мин. В подобных случаях отсутствует дыхательная аритмия, а при физической нагрузке правильная форма трепетания переходит в неправильную и частота сердечных сокращений увеличивается. Ритм сокращений желудочков сердца может быть правильным также в редких случаях сочетания мерцания или трепетания предсердий с полной атриовентрикулярной блокадой (феномен Фредерика), что в подавляющем большинстве случаев связано с интоксикацией сердечными гликозидами. Частота сердечных сокращений при этом обычно менее 60 в 1 мин.
Мерцательная аритмия у больных с пороками сердца и у больных с нарушениями сократительной функции миокарда желудочков, как правило, осложняется сердечной недостаточностью (Сердечная недостаточность). Так, при митральном стенозе возникновение М.а. может сопровождаться развитием острого отека легких (Отёк легких). Менее выраженные нарушения гемодинамики наблюдаются при умеренно выраженных дистрофических или кардиосклеротических изменениях желудочков. При этом в подавляющем большинстве случаев отмечается тахисистолия, однако если М.а. сочетается с нарушениями атриовентрикулярной проводимости, сердечная недостаточность может возникать при умеренном или сниженном темпе сердечных сокращений даже при отсутствии тяжелых нарушений сократимости миокарда желудочков. Одно из редких, но крайне тяжелых проявлений сердечной недостаточности при М.а. — так называемый аритмогенный шок, развитие которого связано с неадекватно низким сердечным выбросом. Шок может возникнуть при частоте сердечных сокращений порядка 200—300 в 1 мин, а в случае нарушенной сократимости — и при более медленном темпе сердечных сокращений (150—200 в 1 мин). Крайне выраженная тахикардия (более 180—190 сокращений желудочков в 1 мин) возможна лишь у больных, у которых имеются аномальные дополнительные проводящие пути между предсердиями и желудочками, идущие в обход атриовентрикулярного узла, например при синдроме Вольффа — Паркинсона — Уайта (см. Синдром преждевременного возбуждения желудочков сердца). Мерцание предсердий может осложняться образованием в них тромбов. Образование больших шаровидных тромбов в левом предсердии, время от времени закрывающих атриовентрикулярное отверстие (что сопровождается всеми проявлениями внезапной остановки сердечной деятельности), иногда наблюдается при митральном стенозе, осложненном М.а. Гораздо чаще в предсердиях образуются тромбы, расположенные пристеночно. Если подобный тромб полностью не организовался, фрагменты тромботических масс иногда отрываются и вызывают эмболию артерий большого или малого круга кровообращения. Это осложнение чаще всего встречается при мерцании предсердий у больных с пороками сердца, особенно при митральном стенозе, когда в связи с дилатацией, отсутствием сократительной деятельности и часто наблюдаемыми повреждениями эндокарда предсердий особенно легко возникают условия, способствующие тромбообразованию. Изредка тромбоэмболии отмечаются и у больных с мерцанием предсердий без поражений клапанного аппарата сердца, в частности при атеросклерозе с характерной для него склонностью к гиперкоагуляции. Внутрипредсердные тромбы при трепетании предсердий возникают крайне редко в связи с тем, что их сократительная деятельность, и в измененной форме, сохраняется.
Диагноз обычно не представляет трудностей и устанавливается уже при пальпации пульса и аускультации сердца по характерной полной неупорядоченности пульса (его ритма, наполнения и напряжения отдельных пульсовых ударов), неритмичности тонов сердца и существенных колебаний их громкости (чем короче диастолическая пауза, тем громче следующий за ней первый тон). Лишь в редких случаях мерцание и особенно трепетание предсердий ошибочно расценивают как частую экстрасистостолию. Правильную форму трепетания предсердий с кратностью проведения импульсов на желудочки 1:3, по данным общеврачебного исследования, трудно отличить от нормального минусового ритма, а при кратности проведения 1:2 — от синусовой тахикардии. Следует иметь а виду, что в отличие от синусового ритма трепетание предсердий правильной формы характеризуется высокой стабильностью ритма сердца в покое (отсутствует дыхательная аритмия) и при небольшой физической нагрузке, а при более значительной нагрузке частота сокращений скачкообразно изменяется на величину, кратную изменению коэффициента проведения импульсов на желудочки, либо правильная форма трепетания переходит в неправильную или в мерцание предсердий. Изредка М.а. с очень высокой частотой сердечных сокращений ошибочно принимают за пароксизмальную тахикардию.
Подтверждают или уточняют диагноз М.а. с помощью электрокардиографического исследования. На ЭКГ при мелковолновом (рис. 3) и крупноволновом (рис. 4) мерцании предсердий отсутствуют предсердные зубцы Р и все отрезки между комплексами QRS заполнены соответственно мелкими или довольно крупными (иногда 3—4 мм) волнами фибрилляции предсердий (волны f), имеющими частоту выше 400 (обычно 600—800) в 1 мин. Крупноволновая фибрилляция предсердий чаще встречается у больных с пороками сердца, мелковолновая — при диффузных поражениях миокарда. Волны f особенно хорошо видны на ЭКГ, записанных непосредственно с эндокарда предсердий (рис. 5). а также на внутрипищеводных ЭКГ. Регистрация внутрисердечной электрограммы позволяет отличить мерцательную тахиаритмию от желудочковой тахикардии даже у больных с исходной или возникшей во время мерцания предсердной блокадой ножек атриовентрикулярного пучка Гиса. При трепетании предсердий зубец Р на ЭКГ также отсутствует, а между комплексами QRS видны относительно регулярные волны трепетания F с частотой 240—300 и 1 мин (рис. 6 и 7). которые на внутрипищеводной ЭКГ и внутрисердечной электрограмме (рис. 8) выявляются как остроконечные зубцы. На обычных ЭКГ волны f наиболее четко видны в отведениях II, III, aVF и V1, причем характерен плавный переход одной волны в другую в отведениях от конечностей без формирования плоского плато между ними, которое всегда наблюдается при суправентрикулярных тахикардиях. Комплексы QRS при ассоциированном трепетании предсердий характеризуются четкой временно́й связью с определенной точкой (например, вершиной) волны F; при диссоциированном трепетании такая связь отсутствует. Иногда на одной и той же ЭКГ чередуются непродолжительные периоды волн трепетания и волн мерцания. Если частота желудочковых комплексов на ЭКГ при М.а. выше 160 в 1 мин и практически не реагирует на лечение, следует предполагать, что М.а. развилась у больного с дополнительными аномальными предсердно-желудочковыми путями (например, с синдромом Вольффа — Паркинсона — Уайта).
Лечение. Этиотропная терапия М.а. возможна лишь в редких случаях (хирургическое или лекарственное лечение при тиреотоксикозе, хирургическая коррекция пороков сердца). Первый вопрос, на который должен ответить врач, когда он обнаруживает v больного М.а., формулируется так: нужно ли немедленно предпринять попытку нормализации ритма сердца или такая попытка нецелесообразна; в последнем случае следует определить необходимость лечения, направленного на устранение тягостных для больного ощущений и гемодинамических расстройств, связанных с мерцательной аритмией. Тактику врача определяет ряд факторов. Важнейшими из них являются форма М.а. (постоянная или пароксизмальная, тахисистолическая или брадисистолическая); время, прошедшее с момента возникновения М.а.; выраженность субъективной симптоматики; наличие, форма и степень сердечной недостаточности. связанной с М.а.: наличие тромбоэмболических или иных осложнений М.а.: этиология М.а. у данного больного.
Если больной не ощущает аритмии, причем частота сердечных сокращений в покое не превышает 100 в 1 мин, а дефицит пульса отсутствует и объективные симптомы осложнений М.а. не выявляются, тактика врача сводится к наблюдению за дальнейшим течением аритмии. Бессимптомное течение наиболее характерно для постоянной формы мерцательной аритмии у больных без нарушения насосной функции желудочков и у лиц, не страдающих пороками сердца. В таких случаях в каком бы то ни было лечении, в частности лекарственном, нет необходимости. При постоянной форме М.а. у больных с пороками сердца, а также в случаях снижения сократимости миокарда, как правило, выявляется сердечная недостаточность, выраженная в той или иной степени, в связи с чем назначают сердечные гликозиды, нередко (при тахисистолии) в сочетании с β-адреноблокаторами (тахикардия, одышка, признаки застоя в малом или большом круге кровообращения). При указании на тромбоэмболии (Тромбоэмболия) в анамнезе, а также при острых тромбоэмболиях или обнаружении с помощью инструментальных методов тромбов в полостях предсердий проводят антикоагулянтную терапию. В острых ситуациях назначают гепарин и тромболитические ферменты. Хроническая левожелудочковая недостаточность при возникновении М.а. может обостряться, что проявляется сердечной астмой (Сердечная астма) или отеком легких (Отёк легких). В подобных случаях в первую очередь назначают лечение, направленное на борьбу с сердечной недостаточностью (сердечные гликозиды, мочегонные средства, вазодилататоры), что может потребовать направления больного в стационар, а при сердечной астме и отеке легких больных срочно госпитализируют. В условиях стационара определяют тактику дальнейшего лечения, в частности уточняют целесообразность восстановления нормального ритма сердца. Относительными противопоказаниями к восстановлению ритма являются: существование постоянной формы М.а. в течение более 2 лет; данные анамнеза, указывающие на то, что ранее М.а. носила пароксизмальный характер; выраженная кардиомегалия и особенно атриомегалия; наличие внутрисердечного тромбоза и указания в анамнезе на артериальные эмболии. В первых трех случаях, даже если ритм сердца удается восстановить, М. а. вскоре рецидивирует, а у больных с внутрисердечным тромбозом или тромбоэмболическими осложнениями весьма вероятно возникновение тромбоэмболий в первые дни после восстановления синусового ритма сердца (так называемая нормализационная тромбоэмболия).
При появлении пароксизма М.а. его купирование начинают с применения лекарственных средств, особенно если этот пароксизм не является первым, не сопровождается острой сердечной недостаточностью и ранее купировался лекарственными средствами. Для нормализации ритма сердца у больных с постоянной М.а. обычно применяют электроимпульсную терапию (Электроимпульсная терапия), значительно реже противоаритмические лекарственные средства. Перед плановым восстановлением ритма сердца проводят (с обязательным учетом противопоказаний) антикоагулянтную терапию, чтобы возможные рыхлые тромбы в полостях сердца успели прорасти соединительной тканью и опасность фрагментации и отрыва внутриполостного тромба при восстановлении сократительной функции предсердий была сведена к минимуму.
Купирование пароксизма мерцательной аритмии начинают, как правило, бригады скорой медицинской помощи. Поскольку никогда нельзя с уверенностью установить, является ли впервые возникшая М.а. началом пароксизма или постоянного нарушения ритма сердца, всех больных с впервые возникшей М.а. экстренно госпитализируют. Электроимпульсная терапия показана для купирования пароксизма М.а. во всех случаях, когда он осложняется острой левожелудочковой недостаточностью. Обычно в стационаре стремятся подобрать Противоаритмические средства, которыми больной может пользоваться для купирования повторных пароксизмов в домашних условиях.
Наиболее эффективным средством лекарственного купирования М.а. является хинидин (хинидина сульфат). Для исключения идиосинкразии к хинидину за час — полтора до начала лечения больному дают пробную дозу препарата — 0,05 г. Проявления идиосинкразии (зуд, кожная сыпь, чувство жара) обычно возникают уже через 30—40 мин после приема пробной дозы. Если этих проявлений нет, дальнейшее лечение хинидином проводят по следующей схеме: первая доза — 0,5 г (0,4—0,6 г); затем через каждый час, если синусовый ритм не восстановился, дают больному по 0,2 г хинидина до нормализации сердечного ритма либо до появления побочных действий или до достижения суммарной дозы хинидина 1,2 г. Если побочные явления полностью отсутствуют, суммарная доза может быть доведена до 1,6 и даже 2 г. При таком форсированном лечении хинидином, если оно проводится впервые, необходимо постоянною присутствие врача в связи с возможностью развития серьезных осложнений (остановка дыхания, коллапс, фибрилляция желудочков). В процессе лечения осуществляется частый (каждые 20—30 мин) электрокардиографический контроль, т.к. хинидин может угнетать предсердно-желудочковую проводимость, а иногда сам вызывает аритмии сердца. Описанная схема при вполне хорошей переносимости хинидина впоследствии может быть использована больным и в домашних условиях при рецидивировании М.а. Назначение для купирования М.а. препаратов хинидина пролонгированного действия (кинилентина и т.п.) нецелесообразно, т.к., фармакокинетика этих препаратов характеризуется медленным увеличением концентрации лекарственного вещества в крови, а их применение рассчитано на поддержание более или менее стабильного уровня действующего вещества в крови с целью предупреждения рецидивов.
Вторым но эффективности препаратом для купирования пароксизма М.а. является дизопирамид (ритмодан, ритмилен). Первая доза препарата — 0,2—0,3 г; в дальнейшем, если ритм не восстановился, назначают по 0,1 г каждый час, осуществляя электрокардиографический контроль Максимальная суммарная доза не более 1 г. Препарат противопоказан при глаукоме, а также при аденоме предстательной железы (вызывает атонию мочевого пузыря).
Применение некоторых иных, кроме названных, антиаритмических средств в среднем реже дает положительный результат, но индивидуально их эффективность весьма вариабельна. Для купирования М.а. в первые часы после ее возникновения может быть использован новокаинамид внутривенно или перорально. В вену новокаинамид вводят дробными дозами (по 2,5—3 мл 10% раствора каждые 5 мин до достижения суммарной дозы 1 г, то есть 10 мл раствора), поскольку при быстром введении нередко развиваются коллапс или выраженные нарушения внутрижелудочковой проводимости. Внутрь на первый прием дают 1 г препарата; при отсутствии эффекта назначают еще два приема по 0,5 г с интервалами в 1 час. Если имеется возможность постоянно наблюдать за больным и осуществлять контроль ЭКГ, суточную дозу новокаинамида доводят до 4 г, что допустимо только в условиях стационара. Отмечена также возможность купировать М.а. этацизином, боникором, алапинином, внутривенным введением амиодарона. Некоторые врачи предпочитают начинать лечение остро возникшей М.а. с внутривенного введения сердечных гликозидов (Сердечные гликозиды) (строфантина, коргликона), что иногда ведет к нормализации сердечного ритма, а в случаях, когда достигнуть ее не удается, способствует предупреждению сердечной недостаточности. Трепетание предсердий иногда удается устранить с помощью внутривенного введения верапамила (изоптина, финоптина), однако при мерцании предсердий этот препарат неэффективен. Другие противоаритмические средства не способны восстановить синусовый ритм при мерцательной аритмии.
Предупреждение пароксизма мерцательной аритмии с помощью постоянного применения лекарственных средств показано не во всех случаях, что зависит в основном от частоты, длительности и тяжести возникающих пароксизмов. В случаях, когда короткие (до нескольких минут) пароксизмы М.а. распознаются только при длительном мониторировании ЭКГ (см. Мониторное наблюдение) и при более продолжительных пароксизмах, когда сам больной их не ощущает, специальное лекарственное лечение не проводится. Если же пароксизмы М.а. сопровождаются тягостными ощущениями и гемодинамическими нарушениями, тактика определяется частотой приступов. При редких приступах (не чаще 2 раз в месяц) в каждом случае ограничиваются их купированием, а в межприступный период лекарственную терапию не назначают. Если приступы возникают чаще 2 раз в месяц, проводят такую же терапию, как при противорецидивном лечении после нормализации ритма сердца у больных с постоянной формой М.а., непрерывно месяцами или годами, пока эта терапия остается эффективной или пока М.а. не переходит в постоянную форму. Если противоаритмические средства оказываются неэффективными или если больной плохо их переносит, то при отсутствии в межприступный период брадикардии или атриовентрикулярной блокады I—II степени назначают постоянный прием сердечных гликозидов, по возможности в сочетании с бета-адреноблокаторами. Использование в небольших дозах целанида и пиндолола (вискена) допустимо и при умеренной брадикардии. Применение комбинации гликозидов с бета-адреноблокаторами может привести или к предупреждению пароксизмов, или к их урежению и лучшей переносимости, а в редких случаях — к переходу пароксизмальной формы М.а. в легче контролируемую постоянную форму.
В случаях, когда пароксизмы М.а. протекают с выраженной вегетативной дисфункцией, целесообразно применение психотропных средств, которые на длительное время назначает психоневролог. В момент пароксизма любой врач, оказывающий неотложную помощь, может рекомендовать больному рассосать во рту диазепам (5—10 мг) либо нозепам (10—20 мг) или феназепам (0,5—0,1 мг), что существенно уменьшает выраженность вегетативных нарушений и способствует нормализации ритма сердца.
Разработаны и внедряются в клиническую практику имплантируемые электрические дефибрилляторы, генерирующие «по требованию», т.е. при возникновении аритмии, электрический импульс мощностью до 20 дж, воздействующий непосредственно на миокард (см. Дефибрилляция). Однако эти приборы применяются, как правило, при опасных для жизни желудочковых аритмиях (пароксизмы желудочковой тахикардии, рецидивирующая фибрилляция желудочков). Существуют лишь указания на возможность их использования в лечении тяжело протекающей пароксизмальной мерцательной аритмии.
Противорецидивная терапия постоянной мерцательной аритмии проводится больным, у которых был восстановлен синусовый ритм. Наиболее эффективен хинидин. Его назначают в суточной дозе 0,8—1,8 г (по 0,2—0,3 г каждые 4—6 ч без ночного перерыва), однако лишь немногие способны педантично исполнять такое предписание врача в течение нескольких месяцев или лет. Кроме того, около половины больных плохо переносят длительный прием хинидина. В связи с этим предложены препараты хинидина пролонгированного действия: таблетки с медленно растворимой основой — Chinidini durules, или кинилентин (хинидина бисульфат), и др. Кинилентин назначают в дозе 0,5 г 2—3 раза в сутки с равными интервалами между приемами препарата; он реже, чем хинидина сульфат, вызывает побочные действия. От длительного применения с противорецидивной целью новокаинамида в 80-е гг. отказались в связи с появлением более эффективных и менее токсичных препаратов. В ряде случаев стабилизации восстановленного ритма удается достигнуть с помощью постоянного приема дизопирамида (по 0,2 г 3—4 раза в сутки), во многих случаях весьма эффективен этацизин (по 0,05—0,1 г 3 раза в день). В первые дни после начала лечения этацизином необходим ежедневный электрокардиографический контроль, т.к. это средство может значительно угнетать внутрижелудочковую проводимость. В некоторых случаях удовлетворительный противорецидивный эффект достигается при назначении β-адреноблокаторов.
Наиболее удобна для больного и достаточно эффективна противорецидивная терапия амиодароном (кордароном). Крайне медленная элиминация из организма этого лекарственного средства (период полувыведения — около месяца) требует применения его по особым схемам, предусматривающим период приема в достаточно высокой (насыщающей) дозе с последующим длительным приемом небольшой поддерживающей дозы. Чаще всего придерживаются следующей схемы: первая неделя — 0,6 г в сутки, вторая неделя — 0,4 г в сутки, затем постоянно по 0,2 г в сутки. Если амиодарон не вызывает диспепсии, суточная доза может быть принята сразу. Больным, масса которых не превышает 60 кг, рекомендуют принимать поддерживающую дозу амиодарона 5 раз в неделю. При использовании такой схемы эффективная концентрация лекарственного вещества в крови создается лишь на 10—15-й день лечения. Чтобы ускорить ее достижение иногда в первые 3 дня, назначают амиодарон в суточной дозе 1,2 г. Величина поддерживающей дозы зависит от массы больного и индивидуальных особенностей фармакокинетики. У очень тучных больных для достижения стойкого противорецидивного действия поддерживающая доза может составлять 0,3—0,4 г в сутки. Прием амиодарона в указанных дозах иногда сопровождается побочными действиями. Некоторые из них, например фотодерматоз (следует избегать длительного солнечного облучения) или отложение пигмента липофусцина в передней камере глаза или в коже, исчезают после отмены препарата. Редким, но весьма серьезным следствием побочных действий амиодарона является фиброзирующий пульмонит, что делает необходимым периодическое целенаправленное исследование легких у больных, получающих этот препарат.
Противорецидивное лечение во всех случаях должно проводиться длительно (месяцами и годами) и непрерывно. Основанием для прекращения приема лекарственного средства служит только его непереносимость или неэффективность. В подобных случаях пытаются подобрать для противорецидивной терапии какой-либо другой препарат.
Прогноз зависит в первую очередь от того, каким заболеванием вызвана М.а. Так, при пороках сердца ее возникновение ведет к быстрому развитию сердечной недостаточности; то же наблюдается и при заболеваниях, сопровождающихся обширными и тяжелыми поражениями сердечной мышцы (крупноочаговый инфаркт миокарда, обширный или диффузный кардиосклероз, дилатационная кардиомиопатия и др.). Ухудшает прогноз наличие тромбоэмболических осложнений. При отсутствии пороков сердца, аномальных проводящих путей между предсердиями и желудочками и хорошем функциональном состоянии миокарда желудочков прогноз благоприятен, хотя частые пароксизмы М.а. могут существенно снижать качество жизни больного. Так называемая идиопатическая М.а. не оказывает никакого влияния на самочувствие и состояние человека, причем причину ее выявить не удается; в подобных случаях люди остаются практически здоровыми и нередко в течение многих лет выполняют тяжелую физическую работу.
Профилактика состоит в предупреждении и своевременном лечении заболеваний, которые могут осложняться М.а. Вторичная профилактика включает, помимо лекарственной противорецидивной терапии, рекомендации по ограничению физических нагрузок, особенно резкого перехода от неподвижного или медленного движения к быстрому. Крайне желательны ограничение психических нагрузок, возможное ограждение больного от тяжелых стрессовых ситуаций. Необходимо настоятельно рекомендовать больным полное воздержание от спиртных напитков, т.к. алкоголь — один из наиболее сильных провоцирующих факторов возникновения пароксизма или рецидива мерцательной аритмии.
Библиогр.: Дзяк В.Н. Мерцательная аритмия, Киев, 1979, библиогр; Кушаковский М.С. Фибрилляция и трепетание предсердий, Кардиология, т. 24, № 5, 1984, библиогр.; Мазур Н.А. Пароксизмальные тахикардии, с. 110, М., 1984; Обухова А.А. и др. Мерцательная аритмия, Саратов, 1986; Янушкевичус З.И. и др. Нарушения ритма и проводимости сердца, М., 1984.
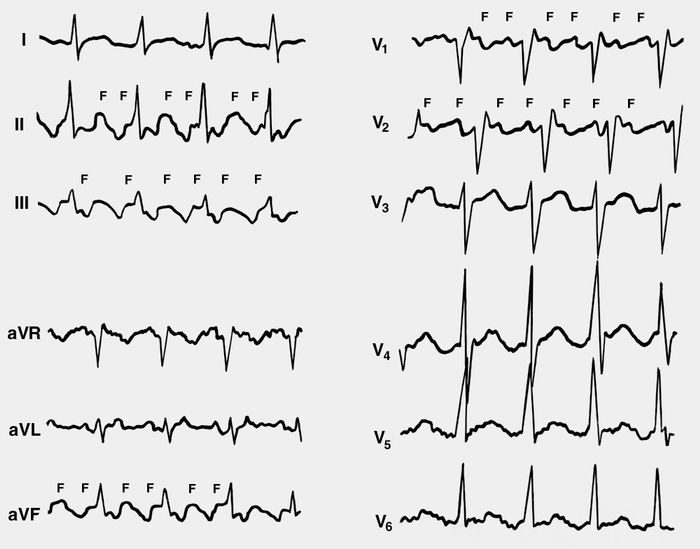
Рис. 6. Электрокардиограммы при правильной форме ассоциированного трепетания предсердий: предсердный зубец Р отсутствует; в отведениях II, III, aVF, V1, V2 видны регулярные плавно переходящие одна в другую волны трепетания F, причем каждый желудочковый комплекс начинается в строго определенную фазу каждой второй волны F. Скорость записи 25 мм/с, масштаб 1:1,5.
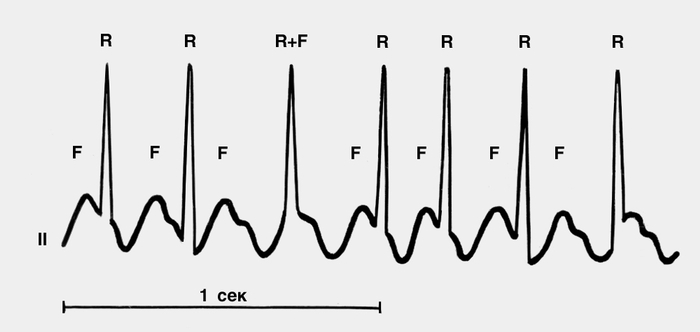
Рис. 7. Электрокардиограммы при диссоциированном трепетании предсердий. В отведении II четко видны волны трепетания F; желудочковые комплексы не имеют с ними постоянной связи. Скорость записи 25 мм/с, масштаб 1:1.
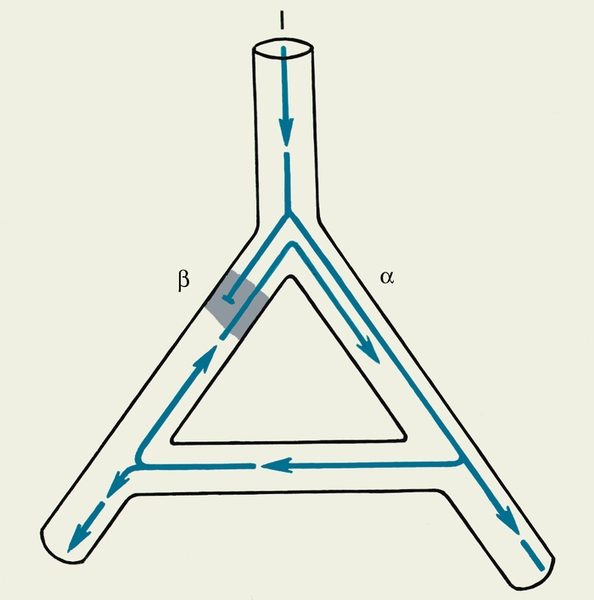 движение импульса блокируется в участке с повышенной рефрактерностью или отсутствием антероградного проведения (участок обозначен штриховкой). В связи с этим импульс проходит только по волокну α, попадая затем а волокно β с противоположной стороны. Этот процесс повторяется до тех пор, пока волокно β не выйдет из состояния рефрактерности, после чего очередной импульс возвращается из волокна β в волокно α и образуется порочная циркуляция волны возбуждения">
движение импульса блокируется в участке с повышенной рефрактерностью или отсутствием антероградного проведения (участок обозначен штриховкой). В связи с этим импульс проходит только по волокну α, попадая затем а волокно β с противоположной стороны. Этот процесс повторяется до тех пор, пока волокно β не выйдет из состояния рефрактерности, после чего очередной импульс возвращается из волокна β в волокно α и образуется порочная циркуляция волны возбуждения">Рис. 1. Схема модели повторного входа возбуждения в миокард (micro-reetry): импульс возбуждения (1) движется в направлении, указанном стрелками, по проводящим волокнам α и β; в волокне β движение импульса блокируется в участке с повышенной рефрактерностью или отсутствием антероградного проведения (участок обозначен штриховкой). В связи с этим импульс проходит только по волокну α, попадая затем а волокно β с противоположной стороны. Этот процесс повторяется до тех пор, пока волокно β не выйдет из состояния рефрактерности, после чего очередной импульс возвращается из волокна β в волокно α и образуется порочная циркуляция волны возбуждения.
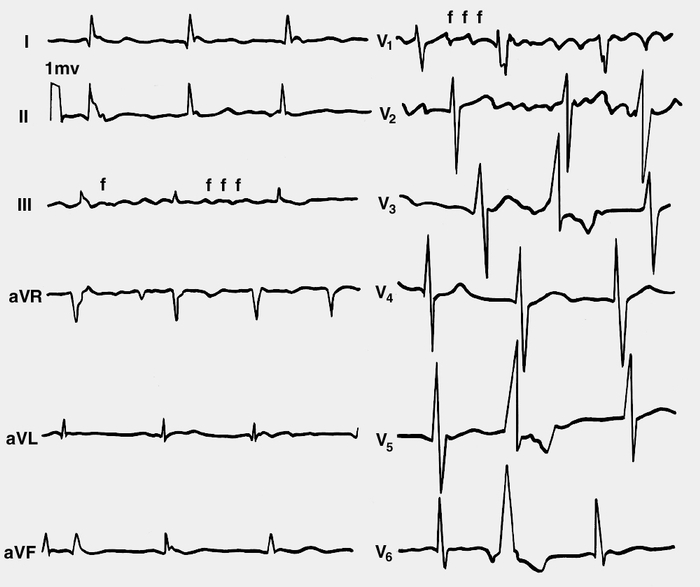
Рис. 4. Электрокардиограммы при крупноволновой форме мерцательной аритмии: предсердный зубец Р отсутствует; сравнительно крупные волны мерцания предсердий f хорошо видны в отведениях III и V1; в отведениях V2, V5, V6 регистрируются деформированные желудочковые комплексы, представляющие собой или желудочковые экстрасистолы, или наджелудочковые комплексы с аберрантным внутрижелудочковым проведением (при мерцательной аритмии строго дифференцировать эти комплексы позволяет только внутрисердечное электрофизиологическое исследование). Скорость записи 25 мм/с, масштаб 1:2.
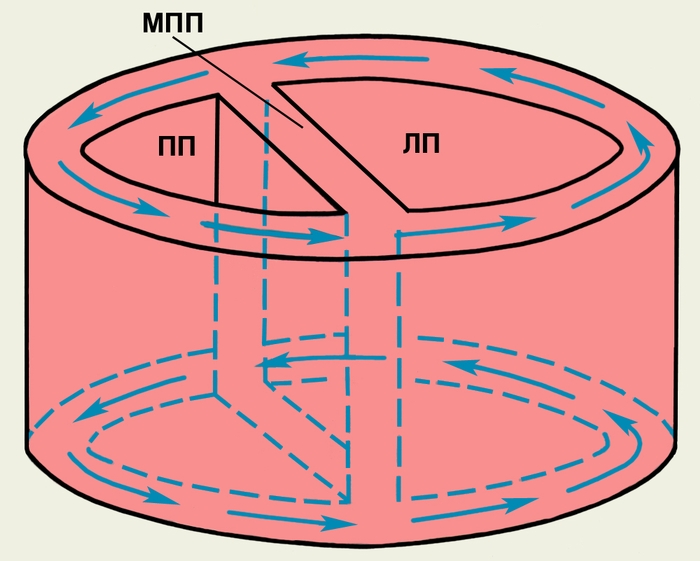 межпредсердная перегородка; стрелками обозначено движение импульса возбуждения по миокарду предсердий">
межпредсердная перегородка; стрелками обозначено движение импульса возбуждения по миокарду предсердий">Рис. 2. Схема порочной циркуляции возбуждения в предсердиях при их трепетании (macro-reentry); ПП — полость правого предсердия; ЛП — полость левого предсердия; МПП — межпредсердная перегородка; стрелками обозначено движение импульса возбуждения по миокарду предсердий.
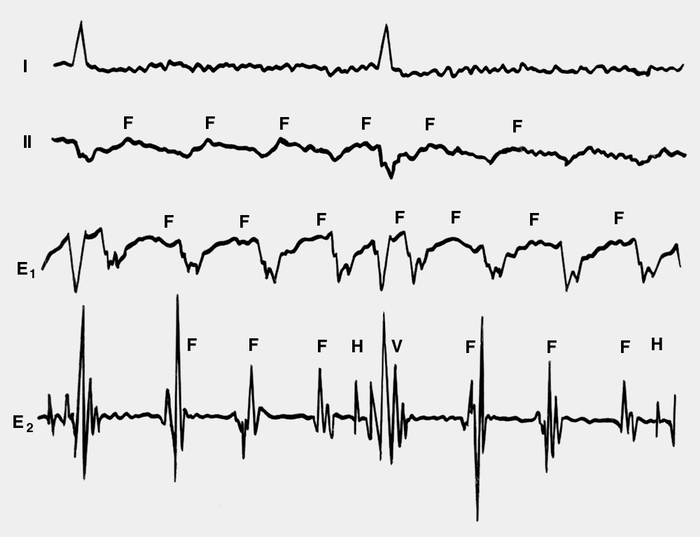
Рис. 8. Электрокардиограммы в отведениях I и II (две верхние кривые) и внутрисердечные электрограммы в отведениях Е1 и Е2 (две нижние кривые) при неправильной ассоциированной форме трепетания предсердий: в отведении II видны волны трепетания F; в отведении из правого предсердия (Е1) и от атриовентрикулярного узла (E2) видны регулярные зубцы трепетания F, имеющие четкие временные соотношения с желудочковыми комплексами (V). Разная амплитуда зубцов в отведении Е2 связана с движениями кончика зонда-электрода. Наличие низкоамплитудного потенциала атриовентрикулярного пучка Гиса (зубец Н) перед каждым желудочковым комплексом свидетельствует о том, что импульсы поступают из предсердий в желудочки через атриовентрикулярное соединение. Скорость записи 50 мм/с, масштаб — 1:2.
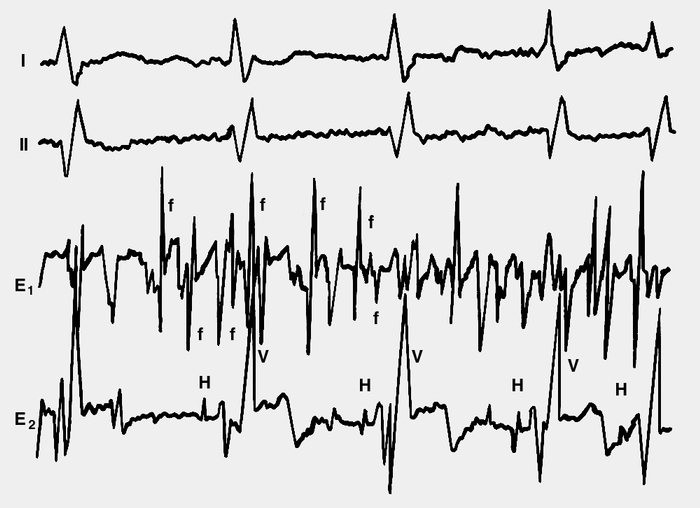
Рис. 5. Электрокардиограммы в отведениях I и II (две верхние кривые) и внутрисердечные электрограммы (две нижние кривые) при мерцательной аритмии: Е1 — отведение из полости правого предсердия (хорошо видны неправильно чередующиеся зубцы мерцания предсердий f, имеющие разную форму и амплитуду); Е2 — отведение от атриовентрикулярного узла, в котором перед каждым желудочковым комплексом (V) виден небольшой зубец Н (потенциал атриовентрикулярного пучка Гиса), что свидетельствует о проведении импульсов в желудочки сердца через атриовентрикулярное соединение. Скорость записи 50 мм/с, масштаб 1:2.
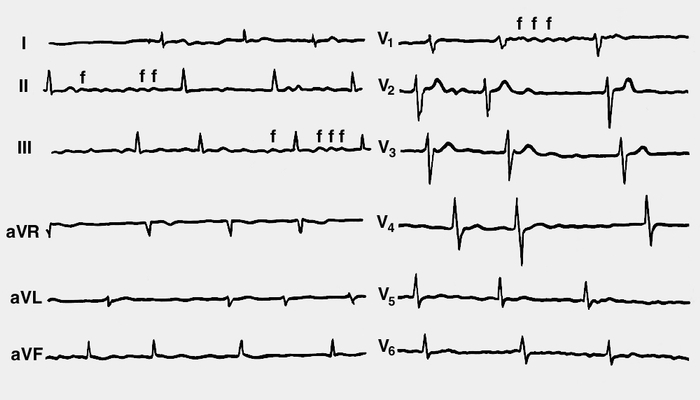
Рис. 3. Электрокардиограммы при мелковолновой форме мерцательной аритмии: предсердный зубец Р отсутствует; видны мелкие волны мерцания предсердий f, особенно хорошо различимые в отведениях II, III и V1. Скорость записи 25 мм/с, масштаб 1:1,7.
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг.