Сердце (лат. соr, греч. cardia) — полый фиброзно-мышечный орган, который, функционируя как насос, обеспечивает движение крови а системе кровообращения.
Анатомия
Сердце находится в переднем средостении (Средостение) в Перикарде между листками медиастинальной плевры (Плевра). Оно имеет форму неправильного конуса (рис. 1) с основанием вверху и обращенной книзу, влево и кпереди верхушкой. Размеры С. индивидуально различны. Длина С. взрослого человека колеблется от 10 до 15 см (чаще 12—13 см), ширина в основании 8—11 см (чаще 9—10 см) и переднезадний размер 6—8,5 см (чаще 6, 5—7 см). Масса С. в среднем составляет у мужчин 332 г (от 274 до 385 г), у женщин — 253 г (от 203 до 302 г).
По отношению к средней линии тела С. располагается несимметрично — около 2/3 слева от нее и около 1/3 — справа. В зависимости от направления проекции продольной оси (от середины его основания до верхушки) на переднюю грудную стенку различают поперечное, косое и вертикальное положение С. Вертикальное положение чаще встречается у людей с узкой и длинной грудной клеткой, поперечное — у лиц с широкой и короткой грудной клеткой.
Сердце состоит из четырех камер: двух (правого и левого) предсердий и двух (правого и левого) желудочков (рис. 2). Предсердия находятся в основании сердца. Спереди из С. выходят аорта и легочный ствол, в правой части в него впадают верхняя полая вена, в задненижней — нижняя полая вена, сзади и слева — левые легочные вены, а несколько правее — правые легочные вены. Различают переднюю (грудинореберную), нижнюю (диафрагмальную), которую в клинике иногда называют задней, и левую боковую (легочную) поверхности сердца. Выделяют также правый край С., образованный в основном правым предсердием и примыкающий к правому легкому. Передняя поверхность, прилежащая к грудине и хрящам левых III—V ребер (рис. 3), на большем протяжении представлена правым желудочком, на меньшем — левым желудочком и предсердиями (рис. 4, а). Границе между желудочками соответствует передняя межжелудочковая борозда, а между желудочками и предсердиями — венечная борозда. В передней межжелудочковой борозде располагаются передняя межжелудочковая ветвь левой венечной артерии (рис. 1, 8), большая вена С. (рис. 1, 7), нервное сплетение и отводящие лимфатические сосуды; в венечной борозде правая венечная артерия, нервное сплетение и лимфатические сосуды. Диафрагмальная поверхность С. обращена вниз и прилежит к диафрагме. Она составлена левым желудочком, частично правым желудочком и участками правого и левого предсердий. На диафрагмальной поверхности оба желудочка граничат друг с другом по задней межжелудочковой борозде, в которой проходят задняя межжелудочковая ветвь правой венечной артерии, средняя вена С., нервы и лимфатические сосуды. Задняя межжелудочковая борозда вблизи верхушки С. соединяется с передней, образуя вырезку верхушки сердца. Силуэт фронтальной проекции сердца на пере днюю грудную стенку (рис. 3) имеет правую, нижнюю и левую границы. Правая граница образуется вверху (II—III ребро) краем верхней полой вены, внизу (III—V ребро) — краем правого предсердия. На уровне V ребра правая граница переходит в нижнюю, которая образована краем правого и частично левого желудочков и идет косо вниз и влево, пересекая грудину над основанием мечевидного отростка, к межреберному промежутку слева и далее, пересекая хрящ VI ребра, достигает V межреберного промежутка на 1,5 см кнутри от среднеключичной линии. Левая граница образована дугой аорты, легочным стволом, левым ушком С. и левым желудочком. Места выхода аорты и легочного ствола проецируются на уровне III межреберного промежутка: устье аорты — позади левой половины грудины, а устье легочного ствола — у левого ее края.
Структура камер С. соответствует его функции как насоса. Правое предсердие с правым желудочком, левое — с левым сообщаются соответственно через правое и левое предсердно-желудочковые отверстия, снабженные клапанами (рис. 2), обеспечивающими направление тока крови из предсердий в желудочки при их диастоле и препятствующими обратному току при систоле желудочков. Сообщение полостей желудочков с артериями регулируется клапанами, расположенными в устьях аорты и легочного ствола. Правый предсердно-желудочный клапан называют трехстворчатым (трикуспидальным), левый — двустворчатым, или митральным.
Правое предсердие имеет неправильную кубическую форму; емкость его у взрослого человека колеблется в пределах 100—140 мл, толщина стенки составляет 2—3 мм. Справа предсердие образует полый отросток — правое ушко. Внутренняя поверхность его имеет ряд гребней, образованных пучками гребенчатых мышц. На латеральной стенке предсердия гребенчатые мышцы оканчиваются, образуя возвышение — пограничный гребень (crista terminalis), которому на наружной поверхности соответствует пограничная борозда (sulcus terminalis). Медиальная стенка предсердия — межпредсердная перегородка — имеет в центре овальную ямку, дно которой образовано, как правило, двумя листками эндокарда. Высота ямки составляет 18—22 мм, ширина — 17—21 мм. У плода на месте овальной ямки располагается овальное отверстие, сообщающее полости предсердий. Иногда оно сохраняется к моменту рождения, обусловливая смещение артериальной и венозной крови. Сзади в правое предсердие вверху впадают верхняя и нижняя полые вены. Устье нижней полой вены ограничено тонкой (складка эндокарда шириной до 10 мм), которая у плода направляет струю крови к овальному отверстию. Между устьями полых вен стенка правого предсердия выпячивается и образует синус полых вен. В задненижнюю часть предсердия впадает венечный синус сердца, имеющий заслонку.
Правый желудочек по форме приближается к трехгранной пирамиде (обращенной основанием кверху), медиальная стенка которой относится к межжелудочковой перегородке. Емкость правого желудочка у взрослых 150—240 мл, толщина стенки 5—7 мм. Вес правого желудочка 64—74 г. В правом желудочке выделяют две части: собственно желудочек и артериальный конус, расположенный в верхней левой части желудочка и продолжающийся в легочный ствол. Диаметр отверстия легочного ствола 17—21 мм. Его клапан состоит из 3 полулунных заслонок: передней, правой и левой. В середине каждой полулунной заслонки имеются утолщения (узелки), способствующие более герметичному смыканию заслонок. Внутренняя поверхность желудочка неровная за счет идущих в различных направлениях мясистых трабекул, которые слабо выражены на межжелудочковой перегородке. Правое предсердно-желудочковое (атриовентрикулярное) отверстие, расположенное вверху желудочка (справа и сзади от отверстия легочного ствола), имеет овальную форму; его продольный размер составляет 29—48 мм, поперечный — 21—46 мм. Клапан этого отверстия, как и митральный клапан, состоит из фиброзного кольца; створок, прикрепляющихся своим основанием к фиброзному кольцу (свободные края створок обращены в полость желудочка); сухожильных хорд, идущих от свободных краев створок к стенке желудочка, к сосочковым мышцам или мясистым трабекулам; сосочковых мышц, образованных внутренним слоем миокарда желудочков. Количество створок клапана лишь немногим чаще, чем в половине случаев, соответствует его обозначению «трехстворчатый»; оно колеблется от 2 до 6, причем большее количество створок встречается при больших размерах атриовентрикулярного отверстия. По месту прикрепления различают переднюю, заднюю и перегородочную створки и соответствующие им сосочковые мышцы, с верхушками которых створки соединены сухожильными хордами. Большое количество сосочковых мышц бывает при увеличенном количестве створок.
Левое предсердие, имеющее близкую к цилиндрической форму, образует слева вырост — левое ушко. Емкость левого предсердия 90—135 мл, толщина стенки 2—3 мм. Внутренняя поверхность стенок предсердия гладкая, за исключением стенок ушка, где имеются валики гребенчатых мышц. На задней стенке расположены устья легочных вен (по две справа и слева). На межпредсердной перегородке со стороны левого предсердия заметна сросшаяся с перегородкой заслонка овального отверстия (valvula foraminis ovalis). Левое ушко более узкое и длинное, чем правое, оно отграничено от предсердия хорошо выраженным перехватом.
Левый желудочек имеет коническую форму. Его емкость от 130 до 220 мл, толщина стенки 11—14 мм. Масса левого желудочка 130—150 г. Из-за закругленности левого края С. передняя и задняя стенки левого желудочка нерезко разграничены, медиальная стенка соответствует межжелудочковой перегородке. Ближайший к отверстию аорты участок левого желудочка называется артериальным конусом. Внутренняя поверхность желудочка, за исключением перегородки, имеет многочисленные мясистые трабекулы. Вверху располагаются два отверстия: слева и спереди — овальное левое предсердно-желудочковое (его продольный размер составляет 23—37 мм, поперечный — 17—33 мм), справа и сзади — отверстие аорты. Клапан левого предсердно-желудочкового отверстия (митральный) имеет чаще всего две створки и соответственно две сосочковые мышцы — переднюю и заднюю. Клапан аорты образован тремя полулунными заслонками — задней, правой и левой. Начальная часть аорты в месте расположения клапана расширена (диаметр ее достигает 22—30 мм) и имеет три углубления — синусы аорты.
Стенки сердца образуются тремя оболочками: наружной — эпикардом, внутренней — эндокардом и расположенной между ними мышечной оболочкой — миокардом. Эпикард — висцеральная пластинка перикарда — является серозной оболочкой. Он состоит из тонкой пластинки соединительной ткани с различным расположением эластических и коллагеновых волокон, покрытой с поверхности мезотелием. Миокард (рис. 5) составляет основную массу стенки сердца. Миокард желудочков отделен от миокарда предсердий фиброзными кольцами, от которых начинаются пучки волокон миокарда. В миокарде желудочков условно можно выделить наружный, средний и внутренний (глубокий) слои. Наружные слои миокарда желудочков общие. Ход волокон наружного и внутреннего слоев имеет вид редкой спирали; средний слой пучков миокарда циркулярный. Гистологически ткань миокарда отличается от поперечнополосатой скелетной мышечной ткани рядом признаков, в т.ч. меньшими размерами клеток миокарда (кардиомиоцитов) и саркомер, наличием в клетке одного ядра, соединением кардиомиоцитов последовательно друг с другом по типу конец в конец посредством вставочных дисков и др. Около 30—40% объема кардиомиоцита занимают митохондрии. Особая насыщенность кардиомиоцитов митохондриями отражает высокий уровень метаболизма ткани, обладающей непрерывной активностью. В миокарде имеется особая система волокон, обладающих способностью проводить импульсы ко всем мышечным слоям С. и координировать последовательность сокращения стенки камер С. Эти специализированные мышечные волокна составляют проводящую систему сердца. Она состоит из синусно-предсердного и предсердно-желудочкового узлов и пучков (предсердных, межузловых соединительных, предсердно-желудочкового и его ветвей и др.). В ткани проводящей системы С., более адаптированной к анаэробному метаболизму, чем сократительный миокард, митохондрии занимают около 10% клеточного объема, а миофибриллы — около 20%. Эндокард выстилает полость С., включая сосочковые мышцы, сухожильные хорды, трабекулы и клапаны. В желудочках эндокард тоньше, чем в предсердиях. Он, как и эпикард, состоит из двух слоев: субэндотелиального и коллагеново-эластического, покрытых эндотелием. Створка клапана сердца представляет собой складку эндокарда, в которой имеется соединительнотканная прослойка.
Иннервация сердца происходит из сердечного сплетения, расположенного под эпикардом, большей частью в стенках предсердий, меньшей — в стенках желудочков (рис. 4). Оно образовано ветвями грудного аортального сплетения, а также имеет сердечные ганглии, содержащие синапсы пре- и постганглионарных парасимпатических нервных волокон. В составе ветвей грудного аортального сплетения к С. подходят постганглионарные симпатические, преганглионарные парасимпатические и чувствительные нервные волокна. Волокна сердечного сплетения формируют вторичные интрамуральные сплетения с чувствительными и мигательными волокнами.
Кровеснабжение сердца осуществляется обычно правой и левой венечной артериями, отходящими от луковицы аорты (рис. 4). В зависимости от преобладающего значения какой-либо из них в обеспечении сердца кровью различают правовенечный (рис. 6) и левовенечный (рис. 7), а также равномерный типы кровоснабжения Левая венечная артерия делится на огибающую и переднюю межжелудочковую ветви. От огибающей артерии отходя несколько ветвей, в т.ч. анастомотическая передняя, предсердно-желудочковые, левая краевая, промежуточная предсердная, задняя левого желудочка, а также ветви синусно-предсердного и предсердно-желудочкового узлов и предсердные ветви. От передней межжелудочковой артерии отделяются ветви артериального конуса, латеральная и перегородочные межжелудочковые. Правая венечная артерия отдает ветвь артериального конуса, ветви синусно-предсердного и предсердно-желудочкового узлов, предсердные и промежуточные предсердные ветви, правую краевую, заднюю межжелудочковую (от нее отходят перегородочные межжелудочковые ветви) и правую заднелатеральную ветвь. Артерии С. ветвятся во всех его оболочках. Благодаря анастомозам в С. может быть коллатеральное кровообращение. Отток крови из вен стенки С. происходит в основном в венечный синус, впадающий в правое предсердие. Кроме того, кровь оттекает непосредственно в правое предсердие через передние вены сердца.
Лимфоотток осуществляется из лимфокапиллярной сети эндокарда в сосуды миокарда, а из сетей миокарда и эпикарда — в субэпикардиальные лимфатические сосуды. Из них формируются правый и левый главные лимфатические сосуды, впадающие в лимфатические узлы средостения
Физиология
Сердце работает как насос, нагнетая кровь в артерии в период сокращения желудочков, или систолу, и заполняясь кровью из вен в период расслабления, или диастолу. Деятельность С. как насоса является основным источником механической энергии движения крови в малом и большом кругах кровообращения (Кровообращение), благодаря чему поддерживается непрерывность обмена веществ и энергии в организме. Энергетическое обеспечение этой деятельности зависит почти исключительно от выработки АТФ в окислительном фосфорилировании, протекающем в митохондриях (см. Клетка) и требующем наличия молекулярного кислорода (прекращение поступления кислорода приводит к быстрому уменьшению сократительной способности миокарда). Для аэробного метаболизма С. главными энергетическими субстратами являются Жирные кислоты, Глюкоза, лактат, пируват (см. Гликолиз) и Кетоновые тела, поступающие в кардиомиоциты из плазмы крови, и в меньшей степени — Аминокислоты. При наличии жирных кислот и углеводов преимущественными энергетическими субстратами для С. являются жирные кислоты, на окисление которых используется около 70% кислорода, потребляемого сердцем. Транспорт глюкозы в кардиомиоциты увеличивается при повышении концентрации глюкозы, в присутствии Инсулина, катехоламинов (Катехоламины), а также в условиях гипоксии и уменьшается при повышении концентрации жирных кислот. Из плазмы крови в кардиомиоциты проникают только свободные жирные кислоты (СЖК). Липопротеины и триглицериды (см. Жиры) плазмы крови могут использоваться в энергетическом обмене С. только после их расщепления до СЖК ферментами. В клетках СЖК активируются с использованием АТФ и образованием ацетил-КоА. Продукт β-окисления СЖК ацетил-КоА подвергается окислению в цикле трикарбоновых кислот (см. Обмен веществ и энергии) до углекислоты и воды. Общая скорость аэробного окисления СЖК и углеводов связана со скоростью потребления кислорода, которая связана линейной зависимостью с работой, выполняемой сердцем. При изменении кровообращения от состояния, соответствующего физическому покою организма, до состояния при максимальных физических нагрузках скорость потребления кислорода С. может меняться в пределах от 50 до 300 мкг․атомов на 1 г сухого веса ткани в 1 мин. Содержание в С. высокоэргических фосфатов (см. Макроэргические соединения) в этих условиях практически не меняется, т.к. их количество, потраченное на сокращение С., быстро восполняется за счет синтеза в митохондриях. При этом важное значение имеет не только образование АТФ из АДФ, но и транспорт энергии в кардиомиоцитах, т.к. для сокращения сердца используется только АТФ, локализованная в миофибриллах и около мембран. Транспортную функцию осуществляет фосфокреатин (ФКр) с участием креатинкиназы, которая катализирует реакцию АТФ + креатин ⇔ ФКр + АДФ, поддерживая тем самым соотношение АТФ:АДФ на постоянном уровне.
Преобразование энергии высокоэргических фосфатов в механическую работу сердечных сокращений связано со специфическими физиологическими функциями отдельных структур С., способствующих преобразованию химической энергии в механическую в определенном ритме. Соответственно, кроме свойства сократимости важными объектами физиологического исследования являются такие свойства С., как автоматия, возбудимость (способность возбуждаться под действием раздражителя), проводимость, рефрактерность и др.
Импульсы возбуждения периодически возникают в С. под влиянием процессов, протекающих в нем самом. Это явление получило название автоматии. Способностью к автоматии обладает специфическая мышечная ткань, формирующая синусно-предсердный узел и проводящую систему сердца. На мембранах клеток специфической мускулатуры С. зарождаются электрические импульсы, переходящие на рабочий миокард и вызывающие его сокращения. Эти процессы связаны с деполяризацией клеточных мембран, которые в состоянии покоя клетки всегда поляризованы вследствие разной концентрации Nа+ и К+ на поверхности и внутри клетки из-за неодинаковой проницаемости мембраны для этих ионов. В состоянии покоя мембрана кардиомиоцита почти непроницаема для Nа+ и частично проницаема для К+, который под действием процесса диффузии выходит из клетки, увеличивая на поверхности мембраны положительный заряд. При этом внутренняя поверхность мембраны приобретает отрицательный заряд, образуется потенциал покоя мембраны порядка 60—80 мВ. Возбуждение клетки связано с увеличением проницаемости мембраны для Nа+, поступление которого в клетку сопровождается деполяризацией мембраны и реверсией потенциала на ее поверхности, т.е. наружная поверхность мембраны приобретает отрицательный электрический заряд. При этом формируется потенциал действия, превышающий на своем пике величину потенциала покоя, достигая значений до 100 мВ и более. Потенциал действия деполяризует мембраны соседних клеток, в результате чего они генерируют собственные потенциалы действия — происходит распространение процесса возбуждения по клеткам миокарда. В отличие от волокон сократительного миокарда мембрана клеток, способных к автоматии, не имеет после выхода из возбуждения постоянного потенциала покоя, т.к. сохраняет некоторую степень проницаемости для Nа+. Вследствие перемещения этих ионов внутрь клетки и одновременного снижения проницаемости для К+ возникает постепенное уменьшение положительного заряда на поверхности мембраны — развивается так называемая медленная диастолическая деполяризация. Когда уровень потенциала покоя уменьшится по сравнению с исходным приблизительно на 20 мВ, возникает резкое увеличение проницаемости мембраны для Nа+, в результате чего Nа+ лавинообразно поступает внутрь клетки, вызывая деполяризацию мембраны и формируя потенциал действия.
Участок, в котором автоматически зарождаются импульсы, ведущие к сокращению С. называют водителем ритма, или Пейсмекером. В нормальных условиях им является синусно-предсердный узел.
Особенностью проводящей системы предсердий и желудочков является способность почти каждой из ее клеток (кроме клеток предсердно-желудочкового узла) самостоятельно генерировать импульсы возбуждения, т. е. она как и синусно-предсердный узел, обладает автоматией. Существует так называемый градиент автоматии, выражающийся в убывании частоты генерации импульсов клетками проводящей системы по мере удаления их от синусно-предсердного узла. Клетки синусно-предсердного узла человека в покое спонтанно генерируют ритмические импульсы возбуждения частотой 60—80 импульсов в минуту, клетки пучка Гиса и его ножек — частотой 30—40 импульсов в минуту, а волокна Пуркинье — частотой около 20 импульсов в минуту. В обычных условиях автоматия всех участков проводящей системы подавляется частыми импульсами, поступающими к ним из синусно-предсердного узла, но в случае поражения последнего водителем ритма может стать ниже расположенный отдел проводящей системы.
Возникнув в синусно-предсердном узле, возбуждение по специальным внутрипредсердным проводящим путям, а также диффузно распространяется по миокарду предсердий, достигает предсердно-желудочкового узла и после некоторой задержки в нем (благодаря которой кровь во время сокращения предсердий заполняет полость еще расслабленных желудочков) распространяется по пучку Гиса и волокнам Пуркинье — к волокнам сократительного миокарда. В миокарде предсердий и желудочков скорость проведения возбуждения составляет 0,9—1,0 м/сек, в волокнах предсердно-желудочкового узла — 0,05 м/сек, пучке Гиса — 1—1,5 м/сек, волокнах Пуркинье — 3 м/сек. Быстрое проведение через волокна Пуркинье обеспечивает почти одновременное возбуждение различных участков миокарда желудочков, что повышает мощность сокращения сердца и эффективность работы желудочков по нагнетанию крови. Время охвата поверхности желудочков возбуждением составляет 10—15 м/сек. Электрические потенциалы, возникновение которых связано с распространением возбуждения по сердцу, можно зарегистрировать при помощи электродов, наложенных на поверхность тела (см. Электрокардиография, Векторкардиография).
Потенциалы действия мембран сердечных волокон представляют собой пусковой механизм, включающий серию внутриклеточных процессов, сопрягающих возбуждение с сокращением миофибрилл. Сокращение мышцы происходит без изменения длины актиновых и миозиновых нитей саркомера — основной сократительной единицы мышечной ткани. Укорочение мышечного волокна достигается за счет вдвигания актиновых нитей между миозиновыми благодаря веслообразным движениям поперечных мостиков — выступающих участков миозиновой нити, образованных из меромиозина, обладающего АТФ-азной активностью. При расслаблении мышцы актиновые нити отодвигаются назад и занимают прежнее положение по отношению к нитям миозина. Актиновые нити состоят из цепочек молекул белка актина, на поверхности которых находятся тонкие нити из белка тропомиозина, блокирующего центры взаимодействия актина с миозином. Тропомиозин образует комплекс с белком тропонином, обладающим высоким сродством к Са2+. Процесс сокращения миокарда запускается Са2+, который поступает к сократительным белкам из цистерн саркоплазматического ретикулума под воздействием импульса возбуждения. Са2+ связывается тропонином, что вызывает изменение пространственного расположения тропонин-тропомиозинового комплекса на актиновой нити, снимая тормозное действие его на активные центры актина. В результате происходит ассоциация актина с миозином — образование актомиозина, идентифицируемое с сокращением, и расщепление АТФ, освобождающее энергию для скольжения актиновых нитей. Процесс расслабления миокарда возникает в результате удаления ионов кальция от тропонина под действием реполяризации мембраны и связывания их саркоплазматическим ретикулумом, а также вследствие «откачивания» ионов кальция насосами клеточных мембран в межклеточную жидкость.
При повторных электрических раздражениях остановленного С. происходит постепенное повышение концентрации ионов кальция внутри клетки, вследствие чего сила каждого последующего сокращения постепенно возрастает до тех пор, пока сокращения не достигнут максимальной величины. Это постепенное возрастание силы сокращений получило название «лестница Боудича». Возможность появления сокращений в ответ на раздражение С. электрическим током используется в современных методах нормализации ритма С. с помощью портативных электростимуляторов (см. Кардиостимуляция).
Сердце нагнетает кровь в сосудистую систему благодаря периодическому последовательному сокращению мышечных клеток предсердий и желудочков. Внутри С. благодаря функции клапанов кровь движется только в одном направлении: в фазе диастолы — из предсердий в желудочки, в фазе систолы желудочков — из правого желудочка в легочный ствол, из левого — в аорту. Захлопывание и открытие клапанов С. связаны с изменением направления градиента давления между сообщающимися камерами в фазы систолы и диастолы желудочков. Движение клапанов С. и перемещение крови вместе с изменением напряжения стенок С. сопровождаются звуковыми феноменами, в частности образованием тонов сердца (Тоны сердца). Около 2/3 объема крови, поступающей в желудочки в фазу диастолы, притекает в связи с положительным давлением крови в экстракардиальных венах, и 1/3 подкачивается в желудочки в фазу систолы предсердий.
Предсердия являются резервуаром для притекающей крови, легко меняющим свою емкость благодаря небольшой толщине их стенок и наличию добавочных емкостей — ушек предсердий, способных при расправлении вместить значительный объем крови.
При каждом сокращении С. правый и левый желудочки изгоняют соответственно в легочный ствол и аорту по 60—70 мл крови — систолический, или ударный, объем крови. Количество крови, нагнетаемое С. в аорту в течение 1 мин, называют минутным объемом крови (МО), а отношение МО к площади поверхности тела — сердечным индексом. Из значений МО и среднего давления крови в аорте определяется внешняя работа сердца, которая в условиях физического покоя составляет у человека 7—11 кгм, а при тяжелой физической работе возрастает до 80 кгм. Энергия, выделяющаяся при деятельности сердца, в 4 раза превышает ту, которую можно определить по величине его внешней работы. По сравнению с другими органами, за исключением коры головного мозга, С. наиболее интенсивно поглощает кислород крови. Поэтому общее кислородное голодание (например, при подъеме на высоту) и перебои в снабжении миокарда кислородом (при нарушениях коронарного кровообращения) быстро нарушают деятельность сердца.
Сердечный индекс у женщин на 7—10% меньше, чем у мужчин. С возрастом величина сердечного индекса уменьшается (по некоторым данным, в среднем на 25 мл/мин/м2 в год).
Снижение регенераторных возможностей организма и интенсивности обменных процессов в пожилом и старческом возрасте сказывается на деятельности С. и уменьшает приспособление его к интенсивным нагрузкам. Кроме того, работа С. затрудняется при артериальной гипертензии, повышении общего периферического сопротивления кровотоку.
Особенности функции С. у детей характеризуются выраженной возрастной динамикой его деятельности по мере совершенствования механизмов ее регуляции.
Регуляция деятельности сердца. Приспособление деятельности С. к изменяющимся потребностям организма в кровоснабжении происходит с помощью регуляторных механизмов, представленных как экстракардиальными нервными и гуморальными влияниями, так и на уровне клеток и межклеточного взаимодействия в самом сердце.
На внутриклеточном уровне осуществляется ауторегуляция скорости синтеза в кардиомиоцитах различных белков в соответствии с их расходом при работе С., а также регуляция интенсивности деятельности С. в соответствии с количеством притекающей к нему крови. Усиленный приток крови обусловливает более сильное растяжение клеток миокарда в момент диастолы. Это приводит к тому, что актиновые нити каждой миофибриллы в большей степени выдвигаются из промежутков между миозиновыми нитями. Происходит рост числа поперечных мостиков, т. е. участков, обеспечивающих соединение актиновых и миозиновых нитей в момент сокращения. В результате каждая миофибрилла и все С. сокращаются тем сильнее, чем больше были растянуты во время диастолы. Эта закономерность получила название закона Старлинга, или Франка — Старлинга (по имени открывших ее ученых).
Регуляция межклеточных взаимодействий в миокарде связана с функцией нексусов — вставочных дисков, обеспечивающих передачу возбуждения с клетки на клетку. Нарушение межклеточных взаимодействий может привести к несинхронности возбуждения и соответственно сокращения отдельных участков миокарда с ослаблением его сократительной функции.
Внутриорганные механизмы регуляции деятельности С. отчетливо обнаруживаются при пересадке С., когда после дегенерации всех нервных элементов экстракардиального происхождения в С. сохраняется и функционирует внутрисердечная нервная система. По типу внутрисердечных (периферических) рефлексов могут возникать рефлекторные влияния с одного отдела С. на другой, изменяющие силу сокращения и другие функции миокарда. Так, при малом в покое исходном кровенаполнении С. увеличение растяжения миокарда правого ушка вследствие возрастания притока крови (например, в связи с изменением положения тела, сокращением скелетных мышц) приводит к усилению сокращений миокарда левого желудочка. Если С. переполнено кровью, то дополнительное растяжение его венозных приемников притекающей кровью угнетает сократительную активность миокарда левого желудочка, вследствие чего в аорту выбрасывается меньше крови. Задержка крови в камерах С. вызывает повышение диастолического давления в его полостях и снижение венозного притока; излишний объем крови, который мог бы привести к резкому подъему АД при внезапном выбросе его в артерии, задерживается в венозной системе, обладающей большой резервной емкостью. В случае недостаточного наполнения кровью камер С. внутрисердечные рефлексы вызывают усиление сокращений миокарда, предотвращая критическое снижение АД. При этом желудочки в момент систолы выбрасывают не половину, а большее количество содержащейся в них крови. Вследствие увеличения при этом градиента венозного притока кровь начинает усиленно притекать к сердцу из вен. Т.о., регуляция деятельности С внутрисердечной нервной системой взаимодействует с внесердечными механизмами регуляции кровяного давления (Кровяное давление) и дополняет их. В естественных условиях внутрисердечная нервная система не является автономной. Она представляет лишь одно из звеньев сложной иерархии механизмов нервной регуляции сердца.
Экстракардиальная нервная регуляция деятельности С. осуществляется ядрами блуждающего нерва в продолговатом мозге и симпатическими нервами верхних пяти грудных сегментов спинного мозга. Импульсы, поступающие к С. по волокнам симпатических нервов, вызывают учащение сердечных сокращений (положительное хронотропное действие), повышают их силу (положительное инотропное действие) и возбудимость миокарда (положительный батмотропный эффект), увеличивают скорость проведения возбуждения (положительный дромотропный эффект). Эти эффекты связаны с возбуждением β-адренорецепторов С. норадреналином, выделяемым окончаниями симпатических нервов. Введение адреномиметиков в С. приводит к таким же изменениям сердечной деятельности, как и раздражение симпатических нервов.
Раздражение сердечных волокон блуждающего нерва, выделяющих ацетилхолин, или введение последнего в С. вызывает урежение и ослабление сокращений сердца, уменьшение возбудимости и замедление скорости проведения возбуждения в миокарде (т.е. отрицательные хроно-, ино-, батмо-, и дромотропный эффекты) вследствие возбуждения м-холинорецепторов сердца.
И.П. Павлов показал, что среди нервных веточек сердечного сплетения имеются волокна, раздражение которых избирательно ведет только к учащению сердечных сокращений (так называемый ускоряющий нерв сердца), и нервные волокна, раздражение которых избирательно увеличивает силу сердечных сокращений (так называемый усиливающий нерв сердца). Усиливающий нерв, по И.П. Павлову, играет трофическую роль. Он оказывает влияние на проведение возбуждения в миокарде. Раздражение его способно устранять блокаду проведения возбуждения в предсердно-желудочковом узле.
Через ядра блуждающих и симпатических нервов реализуются рефлекторные влияния на С., возникающие при раздражении различных рефлексогенных зон. Так, болевые раздражения кожи вызывают рефлекторное учащение сердечных сокращений, раздражение механорецепторов желудка и брюшины — их урежение; при сильном ударе в живот возможна рефлекторная остановка сердца.
Более высокой ступенью иерархии нервной регуляции деятельности С. является Гипоталамус — высший центр регуляции вегетативных функций, обеспечивающий перестройку деятельности сердечно-сосудистой системы и других систем организма по сигналам, поступающим из лимбической системы (Лимбическая система) и коры большого мозга (Кора большого мозга). На этих уровнях интегрально регулируется деятельность всей сердечно-сосудистой системы в соответствии с изменяющимися потребностями организма и всех его органов в кровоснабжении при различных поведенческих реакциях, возникающих в ответ на изменения условий внешней и внутренней среды. Кора головного мозга — орган психической деятельности, обеспечивающий целостные приспособительные реакции организма не только к текущим, но и к будущим событиям. По механизму условных рефлексов сигналы, непосредственно предвещающие наступление этих событий или вероятную возможность их возникновения, могут вызвать необходимую перестройку функций С. и всей сердечно-сосудистой системы в той мере, в какой это необходимо, чтобы обеспечить предстоящую деятельность организма. При очень сложных ситуациях, при действии чрезвычайных раздражителей возможны нарушения и срывы высших регуляторных механизмов, когда наряду с расстройствами поведенческих реакций могут появиться и значительные нарушения деятельности С. и сердечно-сосудистой системы. В некоторых случаях эти нарушения могут закрепиться по типу патологических условных рефлексов.
Гуморальная регуляция деятельности С. в наибольшей степени осуществляется адреналином, секретируемым надпочечниками, и другими веществами, циркулирующими в крови. Адреналин выбрасывается в кровь при эмоциональном и физическом напряжении; он реагирует с β-адренорецепторами мембран сердечных волокон. Возбуждение β-адренорецепторов активирует фермент аденилциклазу, способствующую образованию циклического АМФ, необходимого для превращения неактивной фосфорилазы в активную, что обеспечивает снабжение миокарда энергией. Подобным образом на С. влияют и ионы кальция, активирующие фосфорилазу и обеспечивающие сопряжение возбуждения и сокращения, создавая положительный инотропный эффект. В отличие от этого К+,  , Н+ угнетают силу сокращений миокарда.
, Н+ угнетают силу сокращений миокарда.
 , Н+ угнетают силу сокращений миокарда.
, Н+ угнетают силу сокращений миокарда. Влияют на деятельность С. и различные гормоны. Гормон поджелудочной железы глюкагон оказывает на С. положительный инотропный эффект, стимулируя аденилциклазу; гормон щитовидной железы тироксин увеличивает частоту сердечных сокращений.
В норме в состоянии покоя у взрослых частота сердечных сокращений составляет 60—80 в 1 мин. У новорожденных в регуляции деятельности С. доминирующую роль играет симпатическая нервная система, что наряду с высоким обменом веществ обусловливает высокую частоту сердечных сокращений. По мере повышения в регуляции С. роли блуждающего нерва частота пульса с возрастом постепенно уменьшается. У новорожденных она составляет 120—140 в 1 мин, в возрасте 6 мес. — 130—135, в 1 год — 120—125, в 2—4 года — 100—115, в 5—7 лет — 85—100, в 8—11 лет — 80—85, в 12—15 лет — 70—80 в 1 мин. Число сердечных сокращений у детей одного и того же возраста подвержено индивидуальным колебаниям и зависит от температуры, приема пищи, времени суток, эмоционального состояния и др. У здоровых детей часто наблюдается синусовая (дыхательная) аритмия — вагусный пульс, особенно выраженная у детей дошкольного и школьного возраста. Величина ударного и минутного объемов С. у детей с возрастом увеличивается при уменьшении отношения минутного объема С. к весу тела ребенка. Это отношение, характеризующее потребность организма в кислороде, выше у новорожденных и у детей грудного возраста. Различия ударного и минутного объемов в зависимости от пола ребенка выявляются после 10 лет.
Влияние на сердце нагрузки и факторов окружающей среды. Различные факторы окружающей среды непрерывно изменяют потребить организма в газообмене и питании, в соответствии с чем изменяется и деятельность сердца.
Физические нагрузки вызывают увеличение притока крови к С. вследствие вытеснения ее из вен конечностей сокращающимися мышцами и из вен брюшной полости благодаря повышению давления в ней (за счет напряжения мышц живота). Этот фактор действует в основном при динамических нагрузках, т.е. при ритмической деятельности мышц. Статические нагрузки несущественно изменяют венозный приток. Увеличение венозного притока приводит к значительному возрастанию сердечного выброса. Важными факторами, поддерживающими увеличенный сердечный выброс, являются значительное расширение сосудов работающих мышц и ускорение кровотока, что поддерживает венозный приток к С. на высоком уровне. При максимальной физической нагрузке величина энергетических затрат в миокарде может увеличиться в 120 раз по сравнению с состоянием покоя. В хронических экспериментах на собаках показано, что стандартная физическая нагрузка (бег в тредбане со скоростью 5 км/час) вызывает сохраняющуюся в течение всего периода нагрузки тахикардию, увеличение систолического давления и снижение диастолического давления в левом желудочке, резкое возрастание систолического ускорения кровотока в аорте, увеличение ударного объема и максимальной мощности левого желудочка; при этом значительно усиливается и коронарный кровоток. Такие сдвиги оказывают тренирующее влияние на С., повышая устойчивость сердечно-сосудистой системы к неблагоприятным воздействиям, а сама физическая тренировка становится важным фактором профилактики поражений сердечно-сосудистой системы. Длительное воздействие значительных физических нагрузок приводит к увеличению резервных возможностей сердца.
Отрицательные эмоции (ярость, гнев, тревога, страх), вызывая мобилизацию энергетических ресурсов и выброс в кровь адреналина, способствуют учащению и усилению сердечных сокращений. Эти приспособительные реакции С. полезны лишь при условии разрядки стенических эмоций путем интенсивной мышечной деятельности. Сдерживание физической активности во время стенических эмоций приводит к неиспользованию мобилизованного огромного энергетического потенциала, что может оказать неблагоприятное влияние на сердце.
Под влиянием высотной гипоксии (Гипоксия) наблюдаются изменения функции С., аналогичные возникающим при физических нагрузках. Изменения функции С. в этих условиях направлены на снижение кислородного голодания органов и тканей, появляющегося при понижении парциального давления кислорода в альвеолярном воздухе. Компенсаторные возможности С. не беспредельны. На большой высоте кислородное голодание всех органов и тканей, в т.ч. миокарда, не компенсируется усилением кровообращения. При этом на ЭКГ появляются признаки, характерные для острой диффузной гипоксии миокарда. При более сильных степенях кислородного голодания сердечный ритм урежается, затем наступает асистолия. Периодическое воздействие высотной гипоксии умеренной степени (подъемы на высоту 2000—2500 м над уровнем моря) оказывает положительное тренирующее влияние на сердце.
К факторам окружающей среды, влияющим на деятельность С. относятся резкие колебания температуры и шум. Процессы терморегуляции, обеспечивающие поддержание постоянной температуры тела, осуществляются в значительной мере с участием кровообращения. Наряду с необходимыми для жизни веществами и продуктами жизнедеятельности кровь транспортирует и тепло из органов, где оно вырабатывается (скелетные мышцы, печень, головной мозг и др.), к сосудам кожи и легких, осуществляющим отдачу тепла. Повышение температуры окружающей среды, вызывая расширение сосудов кожи и увеличение теплоотдачи, сопровождается увеличением минутного объема С. Нагрузка на С. при этом дополнительно возрастает из-за повышения вязкости крови в результате потерь воды при усиленном потоотделении; отрицательное влияние на С. оказывает и возникающая потеря организмом солей.
Неблагоприятное влияние интенсивного производственного или бытового шума на сердечно-сосудистую систему связано с его воздействием на психоэмоциональную сферу. Нервное напряжение, создаваемое шумом, способствует повышению сосудистого тонуса и АД, что увеличивает нагрузку на С. Кроме того, при шуме могут возникать неврогенные нарушения сердечного ритма.
Чувствительность органов и тканей к действию ионизирующих излучений (Ионизирующие излучения) пропорциональна митотической активности клеток ткани. С этих позиций миокард можно отнести к радиорезистентным органам. Однако, воздействуя на генетический аппарат, ионизирующее излучение нарушает процессы синтеза белков и вызывает дистрофию миокарда.
Реакции С. на воздействие сильных переменных электромагнитаых полей, так же, как и инфразвуковых волн, имеют, по-видимому, рефлекторную и нейроэндокринную природу. Патогенез этих реакций изучен недостаточно.
Из профессиональных вредностей неблагоприятное влияние на деятельность С. оказывают металлорганические соединения, сероуглерод, свинец, бензол, способные вызвать дистрофию миокарда и нарушать сосудистый тонус.
Патологическая анатомия
Гиперфункция миокарда отдельных камер С. проявляется его компенсаторной гипертрофией. Стенки соответствующей камеры при этом утолщены, масса миокарда увеличена. При гипертонической болезни и аортальных пороках С. гипертрофируется левый желудочек, при гипертензии малого круга кровообращения — правый; гипертрофия предсердий характерна для пороков предсердно-желудочковых клапанов. Компенсаторная гипертрофия миокарда проявляется увеличением массы саркоплазмы мышечных волокон преимущественно за счет гиперплазии внутриклеточных структур: увеличиваются размеры ядра, число миофиламентов, размеры и количество митохондрий. Одновременно отмечается гиперплазия волокнистых структур стромы. Признаком особой патологии С. — гипертрофической Кардиомиопатии — является не компенсаторная, а так называемая идиопатическая гипертрофия миокарда (обычно левого желудочка). Последняя может быть как диффузной, так и локализованной преимущественно в области верхушки С. (апикальная форма) или в верхней части межжелудочковой перегородки (обструктивная форма), сочетаясь иногда с изменением структуры и направления мышечных волокон, фиброзом интерстиция (рис. 8).
При снижении нагрузки на миокард наблюдается атрофия мышечных клеток. Процессы атрофии в С. могут захватывать мышечные клетки всех отделов, что сопровождается уменьшением веса С. —миокардией. Чаще этот процесс отмечается в старческом возрасте и при различных длительно текущих заболеваниях, сопровождающихся истощением. Старческая атрофия С. (старческое сердце), как правило, сочетается с атрофией других органов и систем организма.
Нарушения метаболизма миокарда вследствие его гиперфункции (см. Миокардиодистрофия) и при патологии обмена веществ характеризуются различными по выраженности и качеству признаков вариантами дистрофии кардиомиоцитов (паренхиматозная дистрофия) и стромальных элементов (мезенхимная дистрофия). Выделяют углеводную, жировую, белковую (зернистую), вакуольную (гидропическую) дистрофию и другие проявления дистрофии миокарда.
Углеводная дистрофия кардиомиоцитов проявляется в основном уменьшением или избыточным накоплением в цитоплазме гликогена Наиболее частой причиной уменьшения содержания гликогена в цитоплазме кардиомиоцитов является гипоксия (рис. 9). Избыточное накопление гликогена в кардиомиоцитах возможно при разных заболеваниях, в т.ч. при диабете сахарном (Диабет сахарный), гликогенозах (Гликогенозы). При световой микроскопии оно выявляется по фиолетовому оттенку цитоплазмы (базофилия) при окраске гематоксилином и эозином, а также с помощью специальных окрасок. Подобную базофилию мышечных клеток обозначают как базофильную дегенерацию, или отложение «сердечного коллоида». При электронно-микроскопическом исследовании в цитоплазме кардиомиоцитов обнаруживают обширные поля гликогена.
Жировая дистрофия (при кислородном голодании, экзо- и эндотоксикозах) характеризуется появлением в цитоплазме кардиомиоцитов включений липидов — пылевидных или мелкокапельных. При диффузном характере процесса миокард макроскопически выглядит дряблым, тусклым, глинисто-желтого цвета, иногда с просвечивающей через эндокард желтой пятнистостью (тигровое сердце).
При белковой дистрофии миокард макроскопически дряблый и тусклый. Гистологически мышечные волокна теряют поперечную исчерченность, в их цитоплазме появляются зерна различной величины, окрашивающиеся как кислыми, так и основными красителями. Зернистая дистрофия развивается в результате расстройств кровообращения, а также при токсических воздействиях на миокард. На ранних стадиях дистрофии, особенно при очаговом поражении клетки, процесс обратим. Разновидностью белковой дистрофии является гиалиново-капсульная, при которой глыбки цитоплазмы приобретают форму капель, напоминающих гиалин и интенсивно окрашивающихся кислыми красителями.
Вакуольная дистрофия характеризуется появлением в цитоплазме кардиомиоцитов светооптически прозрачных вакуолей. В основе вакуольной дистрофии лежит не только повреждение белковых структур клетки, но и нарушение водно-электролитного баланса, приводящее к повышению коллоидно-осмотического давления цитоплазмы. Развивающийся при этом отек кардиомиоцитов (так называемая гидропическая дистрофия) приводит к разобщенности органелл, что значительно снижает функцию клетки.
Миоцитолиз — повреждение мышечных клеток миокарда, характеризующееся сначала ослаблением, а затем исчезновением при исследовании в поляризованном свете анизотропии дисков А миофибрилл. Процесс сопровождается ослаблением их тинкториальных свойств, в связи с чем при очаговом его характере кардиомиоциты приобретают вид ткани, как бы изъеденной молью, а при распространении процесса на всю клетку ее цитоплазма в световом микроскопе выглядит оптически пустой (рис. 10). При электронно-микроскопическом исследовании выявляются очаговое или распространенное отсутствие миофибрилл и выраженные деструктивные изменения других органелл. Ядра в таких клетках, как правило, сохранены, что дает основание считать этот процесс в большинстве случаев обратимым. Подобные изменения часто обнаруживаются при адреналовых и токсических повреждениях, а также при метаболических нарушениях по периферии зоны инфаркта миокарда. В основе этого процесса, по-видимому, лежит очаговая активация гидролитических ферментов.
Контрактурный тип повреждения кардиомиоцитов заключается в деструкции миофибриллярного аппарата клетки и характеризуется усилением анизотропии дисков А. Различают несколько стадий развития этого процесса. К необратимым относят те формы повреждения, которые сопровождаются слиянием дисков А в единый конгломерат. Процесс может захватывать несколько саркомеров или всю клетку в целом. В этих мышечных волокнах при световой микроскопии не определяется поперечная исчерченность, а цитоплазма представлена плотным конгломератом, окрашивающимся интенсивно кислыми красителями. Электронно-микроскопическое исследование позволяет установить, что этот конгломерат образован слиянием миозиновых нитей дисков А. При этом происходит изменение архитектоники мышечных клеток с перераспределением в цитоплазме митохондрий и других органелл.
Некроз миокарда развивается в исходе необратимых стадий дистрофии кардиомиоцитов. Макроскопически Некроз выявляется только при вовлечении в процесс группы мышечных клеток или обширной зоны миокарда. Участок некроза отличается более светлой окраской с желтушным оттенком и смазанностью рисунка строения ткани. Светооптическими признаками некроза являются изменения ядра с конденсацией в нем хроматина (кариопикноз), распадом его на глыбки (кариорексис) и с последующим растворением (кариолизис), а также денатурация белка цитоплазмы (коагуляционный некроз) или его избыточная гидратация (колликвационный некроз).
Коронарогенные некрозы (нарушение кровотока в крупной артерии) отличаются от так называемых метаболических некрозов миокарда величиной и особенностями развития. Метаболические некрозы миокарда наблюдаются преимущественно при интоксикациях и гипоксии различного генеза, при Тиреотоксикозе, Стрессе, расстройствах электролитного обмена. Они обычно захватывают несколько мышечных клеток или небольшую группу волокон (рис. 11), располагаются во всех стенках С. с преимущественной локализацией в сосочковых мышцах и субэндокардиальном слое, что свидетельствует о значении в их развитии повышенной функциональной нагрузки.
Фрагментация мышечных волокон заключается в их разрывах на отдельные сегменты (рис. 12). Она может иметь мелкоочаговый характер или захватывать обширные участки миокарда. В зоне фрагментации выявляются различные формы дистрофических и некротических изменений мышечных волокон. Клинико-морфологические сопоставления позволяют предположить, что одной из причин разрыва мышечных волокон является фибрилляция желудочков. С помощью электронно-микроскопического исследования доказано, что разрывы чаще всего располагаются в области вставочных дисков.
В исходе некроза мышечных клеток развивается склероз, который может быть крупноочаговым (постинфарктным), мелкоочаговым (в исходе метаболических некрозов миокарда) и диффузным (см. Кардиосклероз).
Мезенхимные дистрофии С. наблюдаются чаще всего при диффузных заболеваниях соединительной ткани (Диффузные заболевания соединительной ткани) и имеют обычно форму мукоидного и фибриноидного набухания, а также Амилоидоза. Жировая дистрофия стромы миокарда относится, как правило, к жировой инфильтрации и приводит к ожирению С. Увеличение количества жира под эпикардом и в миокарде сопровождается атрофией мышечных волокон, снижением прочности стенки С., что может привести к ее спонтанному разрыву. Причинами ожирения С. являются общие нарушения жирового обмена в организме, а также снижение утилизации жира, например при хроническом алкоголизме. При отравлении этиленгликолем в интерстиции миокарда могут быть обнаружены кристаллы щавелевой кислоты с признаками воспалительной реакции (рис. 13).
Воспалительные процессы могут охватывать все оболочки сердца. В зависимости от преимущественной локализации воспаления различают Эндокардит, Миокардит, Перикардит и Панкардит — поражение всех оболочек С. Относительной специфичностью гистологических признаков, отражающих в определенной мере этиологию воспаления, отличаются гигантоклеточный миокардит (рис. 14), гранулематозный кардит, например при ревматизме (рис. 15), туберкулезе, саркоидозе. По характеру морфологических изменений и наличию возбудителей инфекции в тканях С. можно предположить этиологию воспаления при сифилисе, ряде грибковых и паразитарных поражений сердца. Обычно неспецифический характер имеют гистологические проявления вирусного кардита (рис. 16), миокардита при дифтерии (рис. 17) и ряде других бактериальных инфекций, протозойного миокардита при болезни Шагаса (рис. 18), лекарственного миокардита (рис. 19). При туберкулезе С. наблюдается изолированное или сочетанное поражение эндокарда, миокарда, перикарда. Туберкулезный эндокардит обычно носит характер бородавчатого. Он может быть результатом токсического действия микобактерий туберкулеза или продуктов тканевого распада, а также следствием инфицирования клапанов С. микобактериями туберкулеза с развитием в них специфических бугорков. В миокарде отмечаются солитарные (очаговые) и милиарные формы туберкулеза (Туберкулёз). Последние следует дифференцировать с Саркоидозом С. Очаговый туберкулез чаще наблюдается в правом предсердии или в толще миокарда желудочков. Туберкулезный перикардит обычно бывает экссудативным; при организации фибрина возможна облитерация полости перикарда.
При сифилисе чаще всего возникает мезаортит с распространением воспаления на створки аортального клапана. При этом в начальных фазах процесса в створках клапана выявляются изменения, свойственные гумме (см. Сифилис), с последующим развитием фиброза и формированием клапанного порока С. Сифилитическое поражение миокарда может протекать в форме гуммозного или хронического продуктивного миокардита, отличающегося преобладанием в инфильтрате плазматических клеток, характерным поражением мелких сосудов, наличием гуммозных творожистых очагов.
Грибковые поражения С. встречаются редко. Актиномикоз С. обычно развивается при переходе процесса со средостения или легких на перикард, а затем на миокард. Возникают характерные гнойники с друзами грибка в центре (см. Актиномикоз). полость перикарда подвергается облитерации. Одним из наиболее частых висцеральных микозов является Кандидамикоз. Поражение С. наблюдается обычно при генерализации инфекции и развитии кандидамикозного сепсиса.
Из паразитарных поражений С. в основном встречается Эхинококкоз, реже — Цистицеркоз; крайне редко при вскрытии обнаруживают поражения С., вызванные трихинозом и балантидиазом. При эхинококковой инвазии в миокарде развиваются типичные эхинококковые пузыри, которые могут прорываться в полости С. с диссеминацией сколексов и дочерних пузырей по разным органам. Возможен также прорыв пузырей в полость перикарда.
При первичных опухолях С. патологоанатомическая картина определяется видом опухоли и ее происхождением из эндо- или перикарда. Из доброкачественных опухолей С. наиболее часто встречается миксома, происходящая из эндокарда предсердий, реже рабдомиома (обычно локализованная в форме множественных узлов в стенке желудочков, иногда предсердий), гемангиома, фиброма (рис. 20). Из первичных злокачественных опухолей преобладают мезотелиома перикарда, саркомы С. (чаще исходящие из стенок и перегородки предсердий, реже желудочков), лимфопролиферативные опухоли, в т.ч. иногда грибовидный микоз миокарда (рис. 21). Из сарком чаще встречаются веретенообразно-клеточная, реже гигантоклеточная и круглоклеточная. В некоторых случаях круглоклеточная Саркома диффузно инфильтрирует все С. и вызывает значительное увеличение его размеров. Однако чаще саркома имеет вид узла, разрушающего миокард и дающего метастазы.
Посмертные изменения С. характеризуются трупным окоченением миокарда, которое возникает значительно раньше, чем в поперечнополосатой мускулатуре, создавая ложное впечатление остановки С. в фазе систолы. Явления, близкие трупному окоченению, по-видимому, лежат в основе описанного кардиохирургами феномена «каменного сердца», развивающегося спустя некоторое время после неадекватной медикаментозной кардиоплегии. Микроскопически при этом обнаруживают пересокращение миофибрилл кардиомиоцитов с развитием контрактур. Запуск «каменного сердца» помощью прямого массажа и электрического импульса невозможен.
К поздним посмертным изменениям С. относят имбибицию эндокарда, клапанов и внутренней оболочки сосудов гемоглобином в результате трупного гемолиза крови. При заболеваниях, сопровождающихся прижизненным гемолиом, этот признак появляется в более ранние сроки после смерти. При патологоанатомическом исследовании трупные гипостазы, развивающиеся вследствие отекания крови в задней стенки желудочков и задние отделы межжелудочковой перегородки, следует дифференцировать с развивающимся инфарктом миокарда
Методы исследования
Современная клиника располагает большим количеством специальных методов исследования сердца, которые используют для диагностики его заболеваний наряду с общеклиническим обследованием больного (Обследование больного), включающим помимо аппаратных, инструментальных и лабораторных методов анамнез, осмотр, физикальное исследование сердца. Клиническое исследование С. направлено на выявление структурных (атомо-морфологических) изменений (путем визуализации недоступного непосредственно наблюдению строения, геометрии С. и примыкающих к нему сосудов), а также на обнаружение функциональных изменений деятельности сердца с количественной их характеристикой.
Анамнез и анализ жалоб больного позволяют установить давность, особенности течения болезни С. и ее проявления, специфические для определенной формы патологии сердца: например характер болей в груди при стенокардии (Стенокардия), инфаркте миокарда, перикардите, особенности одышки (Одышка) с выделением сердечной астмы (Сердечная астма), наличие нарушений ритма С. по ощущению больным перебоев в деятельности С.; связь проявлений болезни С. с физической нагрузкой, инфекционными болезнями, что возможно при миокардите, эндокардите и т.д.
Осмотр больного позволяет выявить изменения телосложения и окраски кожи, характерные для некоторых пороков сердца, например «митральный нанизм», «митральный румянец» при митральном стенозе, капиллярный пульс и «пляску каротид» при аортальной недостаточности (см. Пороки сердца приобретенные (Пороки сердца приобретённые)), «сердечный горб» — выбухание грудной клетки в области С. при значительном его увеличен в связи с врожденным пороком или приобретенным в детстве. Во время осмотра обнаруживаются такие признаки сердечной недостаточности (Сердечная недостаточность), как набухание шейных и периферических вен, акроцианоз, Асцит, отеки (Отёки).
Физикальные методы исследования сердца. Пальпация области С. позволяет оценить положение и силу верхушечного толчка С., ее изменения при дилатации и ослаблении сокращений С., при адгезивном перикардите, смещение влево и вниз и усиление при выраженной гипертрофии левого желудочка. С помощью пальпации уточняют выявляемый при осмотре сердечный толчок — сотрясение передней грудной стенки во время систолы С., обусловленный значительной гипертрофией преимуществен правого желудочка. У больных с аортальным или митральным стенозом пальпация области С. иногда позволяет определить соответственно систолическое или диастолическое дрожание. Важную информацию о деятельности С. и ее нарушениях дает пальпаторное исследование пульса (Пульсация), сонных и периферических артерий, имеющее особое значение для оценки ударного объема С. и диагностики аортальных пороков, а также патологической пульсации (Пульсация) в перикардиальной области, наблюдающейся при аневризме сердца (Аневризма сердца), аневризме аорты (Аневризма аорты).
Перкуссия грудной клетки используется для установления топографии и размеров С. путем определения границ так называемой относительной сердечной тупости (соответствующей истинным границам С.) и границ так называемой абсолютной тупости, соответствующей только той части сердца, края не прикрыта легкими. Определяют также поперечник С. и сосудистого пучка. С помощью перкуссии уточняют наличие асцита, Гидроторакса, наблюдающихся при сердечной недостаточности.
Аускультация С. и сосудов дает ценную информацию о функции миокарда и клапанного аппарата С. Оцениваются сердечный ритм, количество выслушиваемых за сердечный цикл тонов сердца и их звучность, выявляются свойственные некоторым клапанным порокам С. Сердечные шумы и Сосудистые шумы, а также шум трения перикарда. Обычно у здоровых лиц выслушиваются два основных сердечных тона — так называемый двучленный ритм; редко у практически здоровых субъектов выявляется расщепление тонов. Расщепление, раздвоение основных тонов и появление дополнительных тонов наблюдаются, как правило, при патологических процессах, хотя у подростков и молодых людей астенического телосложения иногда выслушивается так называемый физиологический III тон. Наличие добавочного III или IV тона обусловливает появление так называемого трехчленного ритма, а выслушивание всех четырех тонов С. определяют как четырехчленный ритм. Выслушивание дополнительных тонов иногда возможно только с помощью специальных приемов аускультации. Так, для выслушивания глухого патологического тона, формирующего ритм галопа (см. Галопа ритм), В.П. Образцов предложил метод непосредственной аускультации С. при плотном прижатии уха врача к грудной клетке больного, что создает условия для лучшего восприятия низкочастотных звуков.
Характерными бывают изменения сердечных тонов при аритмиях сердца (Аритмии сердца): неупорядоченность межцикловых интервалов (II тон — I тон) и выраженные различия в громкости тонов при тахисистолической форме мерцательной аритмии (Мерцательная аритмия), «пушечные» тоны при полной атриовентрикулярной блокаде сердца (Блокада сердца), преждевременное появление и изменение громкости тонов при экстрасистолии (Экстрасистолия).
Аускультация некоторых патологических тонов и сердечных шумов имеет патогномоничное или высокоспецифическое значение для диагностики отдельных пороков сердца (например выслушивание «ритма перепела» при митральном стенозе, «шума паровоза» при незаращении артериального протока, распознавания фибринозного перикардита. Иногда наблюдаются так называемые функциональные сердечные шумы, т.е. не связанные с поражением клапанов С., миокарда и перикарда. Уточнение природы этих шумов всегда требует применения дополнительных методов исследования.
Инструментальные методы исследования сердца. К числу инструментальных методов исследования относятся рентгенологические, радионуклидные, ультразвуковые, электрофизиологические и др. Выбор методов в каждом конкретном случае производится с учетом их целевого назначения и информативности, зависит от состояния больного, характера предполагаемой патологии и объема данных, необходимых для установления и уточнения диагноза.
Некоторые инструментальные исследования С. требуют введения в его полости датчиков (зондирование С.) или индикаторов, т.е. являются инвазивными. Их осуществляют путем пункции полостей С. или катетеризации сердца путем проведения катетеров в его полости через крупные периферические сосуды. Для катетеризации правых полостей С. катетер проводят через локтевую, яремную или подключичную вены, левых полостей — через бедренную артерию. Из полости в полость С. катетер проводят по естественным кровеносным путям, иногда транссептальным проколом. Катетеризацию сердца осуществляет квалифицированный персонал в условиях специально оснащенной операционной.
Рентгенологическое исследование включает рентгеноскопию и рентгенографию С., а при необходимости также рентгенокимографию, томографию, рентгеноконтрастные исследования, в т.ч. ангиокардиографию, коронарографию и др. Многопроекционное рентгенологическое исследование позволяет изучить по силуэту С. важнейшие его анатомические части, форму, положение, границы, размеры органа, а также характер движений С. и отдельных его камер.
Рентгенологически различают три основных положения С. в грудной клетке: вертикальное, косое и горизонтальное. При косом положении С. угол наклона его продольной оси к горизонтали составляет 43—48°; при этом большая часть С. расположена слева от срединной линии. При вертикальном положении С., которое наблюдается у лиц с астенической конституцией, угол наклона его продольной оси составляет 49—56°; при этом линия, проведенная через остистые отростки позвонков, как бы делит С. пополам. Горизонтальное положение С. (угол наклона составляет 35—42°) свойственно лицам с короткой и широкой грудной клеткой; большая часть С. при этом находится слева от срединной линии, широко прилежит к высоко стоящему куполу диафрагмы.
При обычном рентгенологическом исследовании тень С. однородна с хорошо очерченными контурами в виде дуг. Их изучение в разных проекциях (прямой, косых и боковых) позволяет выявить рентгеноанатомическую картину С. и крупных сосудов.
В прямой проекции по левому контуру видны четыре дуги, а по правому — две (рис. 22, а). Первая дуга слева образована аортой, вторая — легочным стволом и частично левой легочной артерией, третья — левым ушком, четвертая — левым желудочком. Справа сосудистая дуга сформирована восходящей частью аорты, а сердечная дуга — правым предсердием. Большая часть передней поверхности С. занята правым желудочком. Ближе к нижней части основания тени артериального конуса расположен митральный клапан, справа и несколько ниже — трикуспидальный, а несколько выше и ближе кпереди (по другим проекциям) — клапан аорты
В правой (первой) косой проекции передний контур тени С. и крупных сосудов образован четырьмя дугами: восходящей частью аорты, легочным стволом, выходным отделом правого желудочка и контуром левого желудочка. Задний контур сформирован верхней полой веной, левым и правым предсердиями. Задний контур сердца отделен от позвоночника светлой полосой — ретрокардиальным пространством (рис. 22, б).
В левой (второй) косой проекции передний контур С. образован вверху восходящей частью аорты, ушком правого предсердия, внизу — правым желудочком. Верхняя дуга по заднему контуру С. представлена левым предсердием, нижняя — левым желудочком. Между задним контуром С. и позвоночником имеется светлая полоса — ретрокардиальное пространство. Восходящая часть, дуга и нисходящая часть аорты как бы обрамляют светлый участок, называемый аортальным окном (рис. 22, в).
В левой боковой проекции передний контур образован тремя дугами восходящей частью аорты, легочным стволом, артериальным конусом правого желудочка и правым желудочком. Между грудиной и правым желудочком имеется узкая светлая полоса — ретростернальное пространство. Задний контур сформирован верхней (левое предсердие, правое предсердие) и нижней (формируемой левым желудочком) дугами (рис. 22, г).
У новорожденных С. на рентгенограмме имеет более округлую, чем у взрослых, форму, образуя в прямой проекции справа две, слева три дуги. Сосудистая тень часто прикрыта тенью увеличенной вилочковой железы. К особенностям рентгенологической картины С. у детей раннего возраста относится некоторое увеличение левого желудочка, подобное его гипертрофии и дилатации у взрослых. Верхушка С. приподнята над левым куполом диафрагмы, закруглена. Талия С. выражена да счет западения дуги левого предсердия и увеличения дуги желудочка. По левому контуру видны не четыре, а три дуги (аорта, легочная артерия, левый желудочек). Сосудистый пучок не выступает за пределы позвоночника, иногда справа видна тень верхней полой вены. Нередко у детей при отсутствии патологии С. определяется так называемая митральная его конфигурация за счет поворота С. справа налево Пульсация С. учащенная, небольшой амплитуды У детей старшего возраста рентгеноанатомия С. почти полностью соответствует таковой у взрослых.
Рентгеноскопия позволяет изучить размеры, форму и положение С., его пульсацию, смещение, ротационные движения, провести функциональные пробы. Рентгенографию (Рентгенография) производят при фокусном расстоянии не менее 1,5 м, направляя в прямой проекции центральный пучок рентгеновского излучения на V—VI грудные позвонки снимок выполняют на неглубоком вдохе. Четкие границы С. и сосудов получают при короткой экспозиции излучения (0,1 с) и напряжении на трубке 75—85 кВ. Томографию (Томография) С. применяют с целью изучения левого предсердия и магистральных сосудов.
Патологические изменения С. могут обнаруживаться во всем органе или отдельных его сегментах, что находит отражение в изменениях нормальной конфигурации тени С. на митральную, аортальную или иную. При митральной конфигурации талия С. сглажена за счет увеличения левого предсердия; аортальная конфигурация С. характеризуется резко выраженной талией С., выпуклой дугой левого желудочка, расширенной восходящей частью аорты.
Изменение размеров С. — важный критерий его патологии. По величине рентгенологически различают гипопластическое, капельное, нормальное и увеличенное С., тотальное увеличение С. до огромных размеров определяют как кардиомегалию. Гипопластическое С. встречается у лиц астенической конституции, высокого роста, а также при кахексии. Для него кроме малых размеров характерно срединное вертикальное положение (угол наклона около 60°); правую нижнюю дугу в прямой проекции образует не правое предсердие, а правый желудочек; талия С. сглажена. Так называемое капельное сердце также малых размеров: оно как бы подвешено на крупных сосудах над диафрагмой и не соприкасается с ней. Кардиомегалия наблюдается при декомпенсированных пороках С., некоторых формах миокардита, кардиомиопатиях. О степени увеличения С. судят на основании его измерения — кардиометрии. Увеличение пути оттока из желудочка (размер от верхушки С. до клапана аорты или легочного ствола) отмечается при наличии препятствия оттоку крови (при стенозе устья или при коарктации аорты — для левого желудочка, при стенозе легочного ствола, легочной гипертензии — для правого желудочка). Рентгенологически для левого желудочка это выражается удлинением его верхушки, которая отходит вниз и влево, округлением дуги левого желудочка, а в левой косой проекции —- удлинением всего сердечного овала. Для правого желудочка это выражается увеличением артериального конуса в правой косой проекции и дуги правого желудочка во второй косой проекции. Увеличение пути притока (размер от атриовентрикулярного клапана до верхушки сердца), которое наблюдается при митральной и аортальной недостаточности, дефекте межпредсердной перегородки и др., рентгенологически отображается для левого желудочка более выраженным его расширением, приподнятой верхней границей верхушки С., а в левой косой проекции — увеличением кзади контура левого желудочка, который погружен в диафрагму. Для правого желудочка это выражается высоким положением предсердно-сосудистого угла, округлостью и выхождением его на правый контур, а в левой косой проекции заполнением ретростернального пространства расширенным правым желудочком.
Для диагностики заболеваний С. большое значение имеет анализ пульсаторных движений С. и больших сосудов. Усиленная пульсация отмечается большой амплитудой систолодиастолических движений левого желудочка. Такая пульсация характерна для аортального стеноза, открытого артериального протока. Ослабленная пульсация наблюдается при заболеваниях миокарда и перикарда. Отсутствие пульсации С. на ограниченном участке — признак сдавливающего перикардита. Парадоксальная пульсация — специфический признак аневризмы С. — проявляется тем, что во время сокращения происходит выпячивание, а не втяжение контура. Объективную характеристику пульсации контуров сердечной тени получают с помощью рентгенокимографии.
Томографию С. применяют с целью изучения левого предсердия и магистральных сосудов. Новое и весьма перспективное для изучения морфологических структур С. направление связано с компьютерным построением графических «срезов» сердца, полученных на основе данных многоосевого рентгенологического исследования (компьютерная рентгеновская томография) или на основе феномена ядерно-магнитного резонанса (магнитно-резонансная томография).
Ангиокардиография позволяет получать изображения различных отделов С. и магистральных сосудов, выявлять индивидуальные особенности и аномалии их строения, патологические изменения путей кровотока. Метод дает возможность исследовать кинематику сердца и околосердечных структур с целью оценки их функции. Для этого используют серийную с короткими интервалами фотосъемку или скоростную киноангиокардиографию, а также запись на видеомагнитофон. Важным достоинством этого метода является возможность измерения линейных размеров, площадей, а при исследовании в двух проекциях — и объемов левого желудочка: конечного диастолического, конечного систолического и их разности (объема изгнания). Киноангиокардиография используется и для более детального исследования процессов перемещения крови из полости в полость, определения по диаметру струи диаметра межкамерных отверстий, размеров дефектов, направления и времени патологических сбросов крови. Сочетание этого метода с манометрией полостей сердца, которая осуществляется через же катетеры, что и инъекции рентгеноконтрастной жидкости, позволяет непосредственно рассчитывать объемные скорости потоков и на основании полученных данных — объем патологических сбросов. Важным элементом ангиокардиографии является введение рентгеноконтрастного вещества в систему кровообращения. Для этого используют как метод катетеризации сердца через периферические сосуды, так и пункцию с прямым введением катетеров в полость С. по каналу пункционной иглы. Ангиография в варианте коронарографии (Коронарография) применяется для визуализации коронарной системы С. Ангиокардиография — дорогостоящий и сложный метод, требующий анестезиологического обеспечения, соблюдения асептики, готовности к реанимационным мероприятиям. Поэтому ее использование ограничено главным образом целями кардиохирургии.
Радионуклидные методы исследования, в частности Сцинтиграфия, дают возможность устанавливать наличие патологического процесса по избирательному накоплению радиоактивного вещества в тех или иных областях органа (см. Радионуклидная диагностика). В зависимости от свойств индикатор может распределяться в разных частях органа в соответствии с их кровоснабжением либо избирательно накапливаться в тканях С. вследствие включения в обменные процессы. Чтобы визуализировать миокард, внутривенно вводят 43К или 201Тl; в зонах ишемии плотность изображения ослабевает. При использовании индикаторов 99mТс визуализируются только зоны острого инфаркта миокарда. Сцинтиграфия позволяет не только очертить силуэт области концентрации индикатора, но и отражает его распределение по глубине, т. е. в конечном счете дает сведения об объемах, занимаемых кровью, здоровой и патологически измененной тканью.
Ультразвуковые методы исследования, используемые для неинвазивного изучения как структуры, так и функции С., отличаются высокой информативностью, простотой выполнения и полной безопасностью для больного, в связи с чем они все шире внедряются в диагностическую практику поликлиник. Визуализация структур С. осуществляется с помощью эхокардиографии (Эхокардиография) — метода получения изображения движущегося С. в разрезе в реальном масштабе времени с помощью регистрации эхосигналов, отражаемых от структур С. при направленном воздействии на эти структуры ультразвуком. Метод позволяет оценить состояние и функцию клапанного аппарата С., аорты, легочной артерии, определить толщину стенок камер С. и динамику их изменений в ходе сердечного цикла, размеры камер С. в систолу и диастолу, а также рассчитать массу миокарда, показатели центральной кардиодинамики (конечный диастолический и конечный систолический объемы левого желудочка, его ударный объем, фракцию выброса) и сократительной способности миокарда, в т.ч. один из наиболее точных из тестов — скорость циркуляторного укорочения волокон левого желудочка. Информативность метода повышается вследствие возможности синхронно с эхокардиограммой регистрировать ЭКГ, ФКГ, сфигмограмму центральных сосудов и др., а также при использовании так называемой ультразвуковой допплерографии (см. Ультразвуковая диагностика) — способа определения скорости и направления тока крови по их влиянию на частоту отраженных ультразвуковых волн (эффект Допплера).
Ультразвуковая допплерография позволяет установить, движется ли кровь в сторону приемника ультразвука (датчика) или в противоположную, а также скорость ее движения. Скорость определяется точно, если ось излучаемого датчиком и отражаемого частицами крови ультразвукового пучка совпадает с осью потока крови или если известен угол между этими осями. С помощью ультразвуковой допплерограии выявляют регургитацию крови в полостях С. и крупных сосудах, ее турбулентное движение, иногда дефекты межпредсердной или межжелудочковой перегородки.
Электрофизиологические методы исследования используются для оценки и выявления нарушений функций автоматизма, возбудимости и проводимости тканей С. Основным методом является Электрокардиография, которая широко, в т.ч. в амбулаторной практике, применяется для диагностики ишемии и инфаркта миокарда, сердечных аритмии, а также для наблюдения за ритмом в процессе мониторного наблюдения (Мониторное наблюдение).
В клинике кроме электрокардиографии в стандартных отведениях применяют так называемую электрокардиотопографию — метод регистрации электрического поля С. с помощью большого числа отведений с поверхности грудной клетки (электроды накладывают на 50—400 точек), а также векторкардиографию (Векторкардиография) и внутриполостные электрофизиологические исследования С. Регистрацию внутриполостных электрических потенциалов С. осуществляют с целью диагностики нарушений ритма и проводимости, чаще всего в вариантах электрогисографии и исследований с помощью программируемой стимуляции С. Электрогисография (регистрация электрограммы пучка Гиса) производится при введении в полости С. специальных катетеров с биполярными или полиполярными отводящими электродами. Записывают потенциалы разных уровней проводящей системы желудочков — пучка Гиса, его ножек и волокон Пуркинье. Показаниями к электрогисографии служат сложные нарушения ритма С. Она используется для дифференциации желудочковых и наджелудочковых аритмий, диагностики уровня предсердно-желудочковой блокады, выявления дополнительных путей проведения возбуждения и др., а также для изучения влияния различных лекарственных средств и оперативных вмешательств на проводимость. Электрод для электрогисографии используют также для электростимуляции предсердий и желудочков. Программируемая стимуляция осуществляется путем введения в полость С. двух электродов, один из которых предназначен для регистрации внутриполостной электрограммы, другой — для нанесения серии одиночных и двойных электрических импульсов в определенную фазу сердечного цикла, вызывающих внеочередное сокращение С. Результат исследования дает информацию о функциональном состоянии проводящей системы С., позволяет выяснить скрытые пути проведения, устанавливать точный топический диагноз аритмии. Противопоказания и осложнения при внутриполостном электрофизиологическом исследовании С. такие же, как при катетеризации сердца.
Фонокардиография — метод исследования деятельности С., основанный на регистрации и анализе тонов сердца и сердечных шумов. Используется главным образом для диагностики клапанных пороков сердца (см. Фонокардиография), а в комплексе с электрокардиографией и сфигмографией (Сфигмография) — для исследования фаз сердечного цикла (см. Поликардиография).
Исследование насосной функции сердца состоит в определении динамических или силовых и кинематических величин, характеризующих акт изгнания крови камерами С. и их наполнение: давлений в полостях С. и примыкающих к ним сосудов, объемных скоростей истечения крови из камер и в камеры С., а также ряда параметров внешних проявлений механической деятельности С., косвенно характеризующих сократительную функцию миокарда.
Давление в желудочках С., точнее скорость его приращения по времени, является наиболее прямым источником информации о сократительной функции С., но для его измерения необходима катетеризация желудочка (см. Кровяное давление). В большинстве случаев для характеристики пропульсивной функции измеряют минутный объем С. (произведение ударного сердечного выброса и частоты сердечных сокращений), снижающийся при некоторых пороках С. и при недостаточности миокарда. Измерение производят в условиях основного обмена, а при необходимости в процессе функциональных нагрузок или фармакологических проб, например строфантиновой пробы (см. Сердечная недостаточность). К числу наиболее достоверных методов измерения минутного объема сердца (см. Кровообращение) относятся метод Фика и другие методы, основанные на разведении индикаторов. В условиях поликлиники обычно используют неинвазивные методы определения сердечного выброса, чаще всего реокардиографию (Реокардиография), или судят о сократительной функции С. на основании фазового анализа сердечного цикла. Косвенно оценить механическую деятельность С. помогают также методы исследования пульса (см. Сфигмография), прекордиальных движений грудной стенки (см. Кинетокардиография), реактивных движений тела (см. Баллистокардиография) и др.
Биопсия сердца проводится с целью диагностики различных его заболеваний и патологических состояний на основе прижизненного изучения морфологических изменений в тканях С. Исследуются структурная перестройка кардиомиоцитов, стромы и микроциркуляторного русла миокарда, распространенность и выраженность склероза и гиперэластоза эндокарда или эпикарда и др. Биопсия С. иногда необходима для установления диагноза миокардита, кардиомиопатии, опухоли сердца.
Чрескожная пункционная биопсия С. производится с помощью специальной иглы, имеющей заточенные бранши для захвата и отсекания кусочка ткани. Катетеризационная (эндомиокардиальная) биопсия С. осуществляется специальным катетером — биотомом, имеющим захватывающие и отсекающие ткань цапки. Оба вида биопсии проводятся под контролем электрокардиографического исследования. Полученный материал подвергают морфологическому исследованию. В момент пункции С. и выкусывания кусочка миокарда на ЭКГ появляются единичные или групповые экстрасистолы, могут возникнуть другие нарушения сердечного ритма. Возможные осложнения пункционной биопсии — тампонада С., трепетание и фибрилляция желудочков, коллапс. При катетеризационной биопсии возможны повреждения сосочковых мышц и сухожильных хорд, а также осложнения, общие для катетеризации полостей сердца.
Патология
Патология С. включает пороки развития, повреждения, заболевания и опухоли. Пороки развития собственно сердца и аномалии развития отходящих от С. крупных сосудов объединяют групповым понятием «врожденные пороки сердца». Некоторые пороки развития проявляются лишь врожденными нарушениями проводимости (см. Блокада сердца) или наличием дополнительных проводящих путей (см. Синдром преждевременного возбуждения желудочков сердца).
Врожденные пороки сердца возникают в результате нарушения или незавершенности формообразования структуры сердца и крупных сосудов в периоды внутриутробного и (реже) постнатального развития. Их частота, по разным данным, колеблется от 5,5 до 8,6 на 1000 живых новорожденных. Основную роль в этиологии пороков развития играют экзогенные воздействия на органогенез в критические его периоды, особенно в первом триместре беременности (вирусные и другие заболевания матери, применение ряда лекарственных средств, воздействие ионизирующего излучения и т.п.). В небольшой части случаев пороки развития имеют генетическую природу (4—10%).
Не считая некоторых различий в отдельных классификациях, клинически значимые формы врожденных пороков сердца подразделяют в соответствии с гемодинамическими нарушениями на несколько групп.
I. Пороки с неизмененным или малоизмененным легочным кровотоком: аномалии расположения сердца, аномалии дуги аорты и ее ветвей, отсутствие дуги аорты, стеноз аорты, коарктация аорты взрослого типа, атрезия аортального клапана, митральный стеноз, митральная атрезия, недостаточность митрального клапана, недостаточность клапана легочного ствола, трехпредсердное сердце, пороки венечных артерий сердца, пороки проводящей системы сердца.
II. Пороки с гиперволемией малого круга кровообращения. 1) не сопровождающиеся ранним цианозом: открытый артериальный проток, дефект межпредсердной перегородки, синдром Лютамбаше, дефект межжелудочковой перегородки, комплекс Эйзенменгера, аортолегочный свищ, коарктация аорты детского типа; 2) сопровождающиеся цианозом: трикуспидальная атрезия с нормальным калибром легочного ствола и большим дефектом межжелудочковой перегородки, а также открытый артериальный проток с током крови из легочного ствола в аорту и комплекс Эйзенменгера при выраженной гипертензии в сосудах малого круга.
III. Пороки с гиповолемией малого круга кровообращения: 1) не сопровождающиеся цианозом: изолированный стеноз легочного ствола (инфундибулярный и клапанный); 2) сопровождающиеся цианозом; триада и тетрада Фалло, пентада Фалди, трикуспидальная атрезия с сужением легочного ствола или малым дефектом межжелудочковой перегородки, аномалия Эбштейна, гипоплазия правого желудочка.
IV. Комбинированные пороки: полная транспозиция аорты и легочного ствола, корригированная транспозиция аорты и легочного ствола, синдром Тауссиг — Бинга, отхождение аорты и легочного ствола от правого желудочка, отхождение аорты и легочного ствола от левого желудочка, общий артериальный ствол, трехкамерное сердце с единым желудочком. К этой группе относятся пороки, при которых выявляются нарушения взаимоотношений между различными отделами сердца и крупными сосудами (артериальными стволами, венами).
Наличие и характер изменений кровотока в малом круге кровообращения или их отсутствие, положенные в основу приведенной классификации врожденных пороков сердца, имеют практическое значение для клинической и особенно рентгенологической диагностики вида порока. При пороках I группы рентгенологическая картина представлена изменениями в основном самого С. (аномалии расположения, увеличение отдельных камер) или крупных сосудов. При пороках II группы рентгенологически определяются признаки гиперволемии и гипертензии малого круга кровообращения. Характерны усиление сосудистого рисунка, увеличение калибра артерий и вен легких, признаки гипертрофии правого желудочка, возможны умеренное увеличение левых предсердия и желудочка. На рентгенокимограмме пульсация легочного ствола и его ветвей увеличена. Артериальная легочная гипертензия характеризуется расширением легочного ствола и крупных его ветвей, обедненностью периферического легочного рисунка, узкими легочными венами, увеличенным правым желудочком. Для пороков III группы характерны повышенная прозрачность легочных полей, узкие сосуды, но в отдельных случаях, особенно у взрослых, легочный сосудистый рисунок имеет беспорядочный вид за счет развитой сети коллатералей. Как правило, отмечают выраженную гипертрофию правого желудочка вследствие препятствия оттоку крови из него при стенозе, гипоплазии или атрезии легочного ствола. На рентгенокимограмме отсутствуют пульсация корней легких, однако часто отмечается большая амплитуда пульсации правого желудочка. Рентгенологическая картина изменений камер С. при этих пороках разнообразна. При тетраде Фалло сердце имеет округленную и приподнятую верхушку с резко выраженной талией («деревянный башмак»); расширена и несколько смещена вправо восходящая аорта; область легочного конуса и дуга легочной артерии западает, увеличен правый желудочек. При атрезии трехстворчатого клапана тень сердца изменена, как при тетраде Фалло; отличительный признак — маленький правый желудочек при увеличенном левом. На рентгенокимограмме видно увеличение амплитуды пульсации по правому контуру сердца и восходящей аорты. При аномалии Эбштейна сердце имеет форму графина; отмечается резкое увеличение сердца за счет расширения правого предсердия; атриовазальный угол приподнят, левые камеры С. маленькие, выявляется гипоплазия аорты. При пороках IV группы возможны разные варианты соотношения кровотока в малом и большом кругах кровообращения. Только ангиокардиография позволяет уточнить характер аномалии. При транспозиции больших сосудов С. не имеет типичной конфигурации и больших размеров, увеличено правое предсердие. Ширина сосудистого пучка зависит от соотношения аорты и легочного ствола, но всегда оба сосуда идут параллельно. Наличие или отсутствие сопутствующего стеноза легочного ствола определяет картину избыточного, нормального или обедненного легочного сосудистого рисунка.
Основные нарушения внутрисердечной гемодинамики при отдельных врожденных пороках С. схематически изображены на рис. 23. Некоторые врожденные пороки сердца, например коронарно-сердечный свищ (рис. 23, ж), прорыв аневризмы синуса Вальсальвы (рис. 23, з), встречаются редко. Относительно часто из пороков I и II групп отмечаются, в т.ч. у взрослых, аномалии расположения С. (прежде всего декстрокардия), аномалии дуги аорты, аортальный стеноз и различные варианты коарктации аорты (Коарктация аорты), открытый Артериальный проток, дефекты межпредсердной и межжелудочковой перегородок, а также открытый общий атриовентрикулярный канал; из пороков III группы — Эбштейна аномалия (рис. 23, б), триада (рис. 23, м) и тетрада (рис. 23, и) Фалло (см. Фалло тетрада), изолированный стеноз легочного ствола. Среди других врожденных пороков, наблюдаемых только у детей, встречаются аномальный дренаж легочных вен и полная транспозиция магистральных сосудов.
Декстрокардия — дистопия С. в грудной полости, характеризующаяся расположением большей его части справа от средней линии тела. В подавляющем большинстве случаев она не является изолированной аномалией, сочетаясь с полным обратным расположением внутренних органов. Редкая изолированная декстрокардия может быть как без инверсии полостей сердца (декстроверсия), так и (чаще) с инверсией предсердий и желудочков С. (истинная, или зеркальная, декстрокардия). Зеркальная декстрокардия в отличие от декстроверсии редко сочетается с другими врожденными пороками С., гемодинамика при декстрокардии, как правило, не нарушена.
Диагноз предполагается при обнаружении необычного расположения верхушечного толчка и перкуторно определенных границ С., подтверждается рентгенологически и характерными изменениями ЭКГ. Рентгенол. исследование позволяет выявить зеркальное изображение сердечно-сосудистого пучка (рис. 24); при этом правый контур тени С. образован левым желудочком, а левый — правым предсердием; дуга аорты перекинута через правый бронх. На ЭКГ при стандартной установке электродов отмечаются убывание амплитуды зубцов R и S от правых к левым грудным отведениям, положительный зубец R в отведении аVR, патогномонично зеркальное отражение нормальной ЭКГ в отведениях I и аVL. Лечение при декстрокардии без сочетания с другими аномалиями С. не требуется.
Аномалии дуги аорты встречаются более чем в 20 вариантах: двойная дуга аорты, правая дуга аорты с левым артериальным протоком, аномальное расположение общей сонной артерии, плечеголовного ствола или его ветвей и др.
Клиническая картина независимо от вида аномалий связана со сдавлением трахеи или (и) пищевода. Затруднения проглатывания и особенно дыхания нередко со Стридором у детей являются наиболее частыми признаками порока.
В диагностике аномалий дуги аорты наибольшее значение имеют рентгенотомография трахеи, трахеобронхография, контрастирование пищевода (особенно в косых и боковых проекциях). При расположении грудной части аорты справа или слева пищевод может находиться контрлатерально. Кинотрахеография помогает выявить необычные движения трахеи и моменты ее коллапса. В затруднительных случаях показаны бронхоскопия и ретроградная аортография.
Лечение только оперативное: рассекают сосудистое кольцо и высвобождают трахею и пищевод.
Аортальный стеноз наблюдают в 5—10% всех случаев врожденных пороков сердца, причем примерно у 1/5 больных этот порок сочетается с другими пороками развития С. и магистральных сосудов. В зависимости от локализации сужения различают клапанный (самый частый), подклапанный и надклапанный стеноз аорты. Нарушение гемодинамики (рис. 23, в) обусловлено препятствием выбросу крови из левого желудочка в аорту, что приводит к повышению давления а левом желудочке, гипертрофии его миокарда и повышенной потребности в кислороде. Возникающая при этом относительная недостаточность коронарного кровоснабжения способствует развитию дистрофии, склероза, снижению сократительной функции сердца.
Порок может многие годы протекать без выраженных клинических проявлений. Первыми субъективными симптомами обычно бывают жалобы на боли в области сердца, головокружения, обмороки; одышка появляется позже. Объективные клинические признаки порока такие же, как при приобретенном стенозе устья аорты (см. Пороки сердца приобретенные (Пороки сердца приобретённые)). Диагноз подтверждают обнаружением гипертрофии левого желудочка С. рентгенологически (рис. 25) и по изменениям ЭКГ, данным эхокардиографии, ангиокардиографии, зондирования сердца (характерно значительное повышение градиента давления между левым желудочком и аортой).
Врожденный аортальный стеноз может осложняться бактериальным эндокардитом, в т.ч. со смертельным исходом; повышен также риск внезапной смерти; при декомпенсированном пороке причиной смерти чаще бывает левожелудочковая сердечная недостаточность.
Лечение хирургическое. Детей с сердечной недостаточностью оперируют по жизненным показаниям. Плановые операции выполняют при выраженном аортальном стенозе. Производят аортальную вальвулотомию или протезирование клапана.
Дефект межжелудочковой перегородки — самый частый врожденный порок сердца, сочетающийся иногда с аортальной недостаточностью и другими аномалиями. Дефект локализуется в мембранной части перегородки либо в мышечной, возможно полное отсутствие межжелудочковой перегородки. Гемодинамические нарушения (рис. 23, д) обусловлены сбросом крови из левого в правый желудочек и определяются размерами дефекта, а также соотношением сосудистого сопротивления в большом и малом кругах кровообращения. При небольших дефектах мышечной части перегородки (болезнь Толочинова — Роже) нарушения гемодинамики не имеют клинического значения. Наиболее тяжело протекают пороки С., вызванные дефектом межжелудочковой перегородки с высокой легочной гипертензией (комплекс Эйзенменгера) и сбросом крови через дефект справа налево.
Порок может быть бессимптомным или проявляться частыми пневмониями. У новорожденных с большим дефектом перегородки и высоким легочно-сосудистым сопротивлением быстро возникает сердечная недостаточность. При обследовании больного нередко выявляют сердечный горб, пальпаторно над сердцем в третьем — четвертом межреберье по левому краю грудины определяют систолическое дрожание, там же выслушивают интенсивный систолический шум. Часто обнаруживается акцент II тона С. над легочным стволом.
Предположить дефект межжелудочковой перегородки помогает рентгенологическое исследование. У больных со средними и большими дефектами перегородки находят увеличение обоих желудочков, усиление легочного рисунка в прикорневых отделах легких и расширение тени легочных сосудов (рис. 26). Подтверждают диагноз данными ангиокардиографии (левая вентрикулография) и зондирования сердца.
При крупных дефектах межжелудочковой перегородки более половины детей не доживают до 1 года из-за прогрессирующей сердечной недостаточности или в связи с осложнением порока бактериальным эндокардитом. При малом дефекте возможно спонтанное его закрытие в первые 10 лет жизни, но если этого не происходит, то постепенно нарастает легочная гипертензия, инвалидизирующая больного.
Хирургическое лечение предпочтительно выполнять в возрасте 4—12 лет, если оно не осуществляется неотложно в более раннем возрасте. Операция показана больным, у которых величина шунтового потока крови через дефект составляет более 1/3 объема легочного кровотока. Закрытие дефекта межжелудочковой перегородки осуществляют в условиях искусственного кровообращения. Небольшие дефекты межжелудочковой перегородки ушивают. Если площадь дефекта составляет 2/3 или более площади перегородки, производят пластическое закрытие отверстия заплатами из аутоперикарда или полимерных материалов. Успех операции зависит от исходной степени гемодинамических нарушений в легких. Свыше 95% больных без легочной гипертензии выздоравливает — у них уменьшаются размеры сердца исчезает одышка, дети быстро набирают вес и растут. Успешная коррекция порока снижает вероятность заболевания бактериальным эндокардитом.
Дефект межпредсердной перегородки составляет, по разным данным, 7—16% всех врожденных пороков С., у девочек встречается чаще, чем у мальчиков. Различают так называемые первичные (низкие) и вторичные (высокие) дефекты. Последние могут быть центральными, располагаться в области устья нижней или верхней полых вен. Возможно сочетание с другими пороками, в частности с митральным стенозом (это сочетание известно как синдром Лютамбаше). Нарушения гемодинамики обусловлены сбросом крови из левого в правое предсердие (рис. 23, е), что приводит к объемной перегрузке правых отделов сердца и малого круга кровообращения. Легочная гипертензия нарастает медленно и проявляется только у взрослых.
Клинические проявления, зависящие от величины и локализации дефекта, могут либо отсутствовать. либо характеризоваться задержкой развития ребенка, гипотрофией, застойной сердечной недостаточностью, нарушениями сердечного ритма. При аускультации С. часто определяются мезосистолический шум и расщепление II тона над легочным стволом. На вдохе и выдохе степень расщепления II тона практически не меняется. При большом шунтировании крови через дефект над мечевидным отростком выявляется протодиастолический шум относительного стеноза трехстворчатого клапана. На ЭКГ электрическая ось С. отклонена вправо (при вторичных дефектах) или влево (при первичных дефектах); возможны неполная блокада правой ножки пучка Гиса (см. Блокада сердца), признаки гипертрофии правого желудочка.
Рентгенологическое исследование позволяет обнаружить увеличение правых отделов сердца и усиление кровенаполнения легочных сосудов. Гипертрофия правого желудочка определяется главным образом в правой косой или левой боковой проекциях. Легочный ствол дилатирован, а при высокой гипертензии (рис. 27) может быть аневризматически расширен. При контрастировании левого предсердия обнаруживают отверстие, через которое рентгеноконтрастное вещество поступает в правые отделы С., что подтверждает диагноз.
Лечение оперативное. Закрытие вторичного дефекта перегородки производят на «открытом» сердце в условиях гипертермии или искусственного кровообращения ушиванием или наложением заплаты. Продолжительность жизни неоперированных больных составляет в среднем 40 лет.
Открытый общий атриовентрикулярный канал представляет собой сочетание первичного дефекта межпредсердной перегородки с расщеплением створки митрального и (или) трехстворчатого клапана (неполная форма), а в части случаев также дефекта краниальной части межжелудочковой перегородки (полная форма).
Гемодинамическне нарушения при неполной скорме обусловлены дефектом межжелудочковой перегородки и недостаточностью измененных клапанов, хотя в ряде случаев несмотря на расщепление створок клапаны могут оставаться функционально полноценными. При полной форме дефекты межпредсердной и межжелудочковой перегородок образуют единое отверстие, гемодинамические нарушения (рис. 23, г) характеризуются сбросом крови слева направо на уровне предсердий и желудочков и регургитацией крови из желудочков в предсердия.
Клинические проявления разных форм порока во многом сходны. Больные дети значительно отстают в развитии, истощены, часто имеют «сердечный горб», плохо переносят физическую нагрузку из-за одышки При полном атриовентрикулярном канале сердечная недостаточность проявляется уже в первые недели или месяцы жизни; одышка нередко отмечается в покое, при нагрузке возникает цианоз. Аускультативно при неполной форме порока определяются систолические шумы у основания и на верхушке С., усиление и расщепление II тона С. во втором межреберье слева от грудины. При полной форме порока выслушивается грубый пансистолический шум над всей областью С. (интенсивнее над верхушкой сердца и по левому краю грудины). Рентгенологически определяются умеренная или значительная кардиомегалия и дилатация легочного ствола (рис. 28). Диагноз уточняют с помощью двухмерной эхокардиографии, данных зондирования С. и левой вентрикулографии.
Хирургические лечение полной формы атриовентрикулярного канала — одна из серьезных проблем кардиохирургии как в связи с технической сложностью операции, так и вследствие нарастания тяжести состояния больного уже в первые недели после рождения: до 6 мес. доживают только 54% больных детей (выживаемость до 1 года и до 5 лет составляет соответственно 35% и 4%). Операцию осуществляют в условиях искусственного кровообращения. Вначале устраняют дефект межжелудочковой перегородки, затем сшивают расщепленные створки атриовентрикулярных клапанов, после чего выполняют пластику дефекта межпредсердной перегородки. При неполной форме порока операцию ограничивают, как правило, пластикой дефекта межпредсердной перегородки и лишь при выраженной митральной недостаточности предварительно ушивают расщепленную створку или осуществляют протезирование клапана. У большинства больных после операции уменьшается одышка, возрастает переносимость физической нагрузки. Однако качество жизни оперированных во многом зависит от исходной степени легочной гипертензии и состояния проводящей системы сердца. У 5—10% определяется полная атриовентрикулярная блокада.
Изолированный стеноз легочного ствола одинаково часто встречается у мальчиков и девочек и составляет, по разным данным, от 2 до 11,6% всех врожденных пороков сердца. За редкими исключениями (мышечная дисплазия инфундибулярной части, гипоплазия ствола и др.) порок является клапанным (отмечается сращение створок). Гемодинамические нарушения обусловлены препятствием оттоку крови из правого желудочка, что приводит к его перегрузке, гипертрофии, постепенному развитию дистрофия гиперфункции и недостаточности сократительной функции.
Клинические проявления зависят от степени стеноза. Резко выраженный стеноз характеризуется ранним развитием правожелудочковой недостаточности, повышением давления в правом предсердии, что у новорожденных приводит к шунтированию венозной крови в левое предсердие через открытое овальное окно. В этих случаях у детей наблюдаются диффузный цианоз, картина прогрессирующей застойной недостаточности кровообращения, значительное отставание в развитии. При умеренном стенозе порок в течение нескольких лет может протекать бессимптомно, дети развиваются практически нормально. В последующем появляются утомляемость, одышка при физической нагрузке, боль за грудиной, головокружения, иногда склонность к обморокам. При обследовании больного определяют систолическое дрожание втором — третьем межреберье слева от грудины, здесь же выслушивают грубый систолический шум, проводящийся по направлению к ключицам, II тон сердца над легочным стволом ослаблен. Пальпаторно под мечевидным отростком отмечается усиленная пульсация правого желудочка. На ЭКГ определяются признаки выраженной гипертрофии правых желудочка и предсердия. Рентгенологически выявляют увеличение правого желудочка и постстенотическую дилатацию легочного ствола; периферический легочный рисунок обеднен или снижен. Подтверждают диагноз данными зондирования С. (определяется высокий градиент давления между правым желудочком и легочным стволом) и правой вентрикулографии.
Хирургическое лечение осуществляют при градиенте давления на уровне стеноза выше 60 мм рт. ст. Прогноз для жизни тем серьезнее, чем раньше появляются клинические симптомы порока. Большинство неоперированных больных умирают в подростковом возрасте.
Аномальный дренаж легочных вен встречается у 2% больных с врожденными пороками сердца. Он может быть частичным и тотальным. Последний характеризуется впадением вен правого и левого легкого не в левое предсердие, а в образуемый ими позади С. коллектор и затем в правое предсердие или в крупные вены большого круга кровообращения (полые, плечеголовные и др.). Сохранение жизни при данной аномалии возможно только при наличии открытого овального окна либо дефекта межпредсердной перегородки, через которые смешанная с венозной артериальная кровь поступает из правого предсердия в левые отделы сердца и аорту. При этом правые отделы С. перегружены объемом крови, дилатированы и гипертрофированы, левые — гиперплазированы или нормальны. В большинстве случаев развивается легочная артериальная гипертензия, от выраженности которой во многом зависят характер клинических проявлений и темпы развития сердечной недостаточности.
Клинически порок протекает легче при большом дефекте межпредсердной перегородки, когда цианоз выражен минимально, общее состояние больных относительно удовлетворительное. Однако в большинстве случаев порок характеризуется выраженным цианозом и одышкой, нарастающими при нагрузке, обмороками, отставанием в развитии, прогрессированием правожелудочковой сердечной недостаточности, которая в тяжелых случаях появляется же на первом году жизни ребенка. При обследовании больного определяют увеличение С., печени, усиленный сердечный толчок, резкое усиление и иногда расщепление II тона сердца, а при тяжелой легочной гипертензии также нежный систолический шум над легочным створом (чаще шумы не прослушиваются). На ЭКГ имеются признаки гипертрофии правого желудочка и правого предсердия. При рентгенологическом исследовании у части больных в области основания сердца обнаруживается характерная дополнительная округлая тень (в переднезадней проекции имеет вид восьмерки). Редкое усиление легочного рисунка сочетается с относительно небольшим увеличением размеров сердца, но при выраженной легочной гипертензии сердце большое из-за увеличения его правых отделов. Характер аномалии достоверно определяют с помощью ангиопульмонографии, степень гемодинамических нарушений на основании данных зондирования сердца.
Около 80% детей с аномальным дренажем легочных вен умирает на первом году жизни, поэтому хирургическое лечение порока целесообразно в возрасте 6—12 мес. Операция заключается в создании соустья между левым предсердием и коллектором, в который спадают легочные вены, в выполнении пластики дефекта межпредсердной перегородки, лигировании левой передней кардиальной вены. Общая госпитальная летальность достигает 32%. Отдаленные результаты в целом хорошие, но в части случаев отмечается позднее стенозирование анастомоза.
Полная транспозиция магистральных сосудов характеризуется аномальным отхождением аорты от правого, а легочного ствола от левого желудочков сердца, в связи с чем большой и малый круги кровообращения становятся разобщенными. Жизнь при этом возможна только при наличии других пороков, обеспечивающих сообщение между кругами кровообращения — открытого овального окна, дефектов перегородок С., открытого артериального протока, аномального дренажа легочных вен, аортолегочного свища, данная аномалия часто сочетается со стенозом устья легочного ствола. От нее следует отличать неполную транспозицию сосудов (аномалию Тауссиг — Бинга), при которой аорта отходит от правого желудочка, а легочный ствол — от обоих желудочков, располагаясь как бы верхом чад межжелудочковой перегородкой.
Клинические проявления аномалии во многом зависят от сопутствующих пороков (дефектов перегородки или др.), но во всех случаях основным симптомом заболевания является интенсивный цианоз с первого дня жизни. Обычно у детей отмечаются заметное отставание в физическом развитии, склонность к респираторным заболеваниям, при отсутствии стеноза легочного ствола рано развивается гипертензия малого круга кровообращения. Характерны приступы одышки и одышка в покое, утомляемость, сердцебиение, проявления застойной сердечной недостаточности (гепатомегалия, отеки), пульсация шейных вен, «сердечный горб», расширение границ сердца, усиление и акцент II тона над легочным стволом. В крови обнаруживают высокое содержание гемоглобина (более 330 г/л). эритроцитов (до 11․1012/л), увеличение гематокритного числа. На ЭКГ выявляются крайняя степень отклонения электрической оси сердца вправо, резкая гипертрофия правого желудочка, нарушения внутрисердечной проводимости, иногда перегрузка левого желудочка, нарушение сердечного ритма. Рентгенологически определяется овоидная конфигурация контуров и расширение тени С., в передней проекции отсутствует дуга легочного ствола, увеличена пульсация правого желудочка. При ангиокардиографии достоверным признаком порока является изображение аорты, отходящей от правого желудочка и располагающейся кпереди от легочного ствола.
Хирургическое лечение должно быть как можно более ранним, т.к. средняя продолжительность жизни детей с полной транспозицией магистральных сосудов составляет около 3 мес. Применяют паллиативные и радикальные оперативные вмешательства. К паллиативным относят создание различных сосудистых анастомозов, к радикальным гемодинамическую или анатомическую коррекцию порока. Госпитальная летальность достигает 20%.
Повреждения. Различают закрытые и открытые (ранения) повреждения С. Раны С. могут быть колото-резаные и огнестрельные, не проникающие и проникающие (слепые и сквозные) в полость сердца.
Закрытые повреждения сердца возникают в результате удара или сдавления грудной клетки тяжелыми предметами, воздействия взрывной волной, при падении с высоты и других видах травм. При этом возможны сотрясения и ушибы сердца, разрывы миокарда, повреждения внутрисердечных структур.
Наиболее часто повреждаются желудочки, реже другие отделы С. Нарушение целости венечных артерий, клапанов, перегородок, сухожильных хорд и сосочковых мышц значительно утяжеляет состояние больных. Повреждения сердца нередко сочетаются с переломами ребер, повреждениями легких и других органов.
Сотрясения С. клинически часто проявляются нечетко и без тщательного обследования могут остаться незамеченными. Тяжелые повреждения миокарда без нарушения анатомической целости органа (ушиб) сопровождаются выраженной симптоматикой. Общее состояние пострадавших тяжелое. Большинство из них беспокойны, предъявляют жалобы на сильную боль за грудиной с иррадиацией в левую руку и лопатку, одышку, сердцебиение, общую слабость. Кожа бледная, покрыта холодным потом, видимые слизистые оболочки цианотичны. Характерны тахикардия (140—160 сокращений в 1 мин) и значительная артериальная гипотензия, не корригируемая медикаментозно. Перкуторно практически всегда можно выявить расширение границ С. в поперечнике, а аускультативно — глухость сердечных тонов. Нередко встречающийся тромбоз венечных артерий приводит к развитию инфаркта миокарда с характерными изменениями ЭКГ. Разрывы миокарда, особенно с повреждением венечных сосудов, могут привести к накоплению в полости перикарда крови— гемоперикарду, что может стать причиной развития тампонады сердца (Тампонада сердца) с типичными клиническими проявлениями.
Диагностика скрытых повреждений С. трудна. По данным Н.Н. Малиновского с соавторами (1979), только у 7,8% пострадавших правильный диагноз был поставлен в течение 3 сут. Поэтому во всех случаях травмы грудной клетки врач должен как можно раньше, а при тахикардии и глухих тонах С. в неотложном порядке обеспечить электрокардиографическое исследование. На ЭКГ часто определяют снижение амплитуды и расширение зубца R, смещение сегмента ST от изолинии и инверсию зубца Т, возможны расстройства ритма и проводимости (экстрасистолия, брадикардия, полная или частичная атриовентрикулярная блокада), связанные с повреждением проводящей системы сердца. В условиях стационара срочная селективная коронарография позволяет уточнить характер сосудистых изменений.
Травматические разрывы клапанов, перегородок С., хорд, капиллярных мышц проявляются внезапным возникновением нитевидного систолического шума над областью С., признаков нарастающей сердечной недостаточности, которая может стать причиной смерти пострадавшего.
Лечебная тактика зависит от характера анатомических повреждений и тяжести расстройств сердечной деятельности. Все больные с повреждениями С. подлежат госпитализации. На догоспитальном этапе пострадавшим дают анальгетики, при необходимости — противоаритмические средства, проводят оксигенотерапию. Тщательно следят за проходимостью дыхательных путей. В стационаре при ушибах и сотрясениях С. проводят консервативное лечение. Оно направлено на устранение боли, восполнение кровопотери, улучшение сократительной способности миокарда, нормализацию ритма и проводимости С. восстановление гемодинамики, поддержание проходимости дыхательных путей. Плазмозамещающие растворы и кровь вводят только по строгим показаниям. Назначают постельный режим на 2—3 нед. Обычно такое лечение при сотрясениях и средней тяжести ушибах С. в большинстве случаев приводит к полному выздоровлению через 2—4 нед. после травмы. При тяжелых ушибах С. больных помещают в отделение (блок) реанимации, где терапия проводится под непрерывным мониторным наблюдением за деятельностью сердца и другими жизненно важными функциями, при необходимости осуществляются реанимационные мероприятия.
При травматических разрывах миокарда показано срочное ушивание раны с целью остановки кровотечения и предотвращения тампонады С. Острый тромбоз или значительные повреждения основных стволов венечных артерий с выраженной ишемией миокарда также требуют оперативного вмешательства с целью восстановления артериального кровоснабжения сердца (так называемая артериализация миокарда), например путем аутовенозного аортокоронарного шунтирования. В случае разрыва внутрисердечных структур необходима реконструктивная операция с использованием искусственного кровообращения. Хирургическую коррекцию травматических пороков следует выполнять в период стабилизации гемодинамики до появления признаков сердечной декомпенсации. При успешном применении консервативной терапии наиболее оптимальным сроком для вмешательства считается 2—4-й месяц с момента травмы. При отсутствии эффекта от медикаментозной терапии и резком ухудшении сердечной деятельности показана срочная реконструктивная операция. В предоперационном периоде используют вспомогательное кровообращение (веноартериальное шунтирование с оксигенацией, внутриаортальное баллонирование).
Открытые повреждения сердца в большинстве случаев сопровождаются повреждением легких и плевры с развитием гемопневмоторакса, реже выявляются раны диафрагмы, печени, желудка, селезенки, кишечника, спинного мозга и др. Внеплевральные изолированные ранения встречаются значительно реже.
Тяжесть состояния раненых не всегда можно связать с характером ранения (сквозное, слепое): судьба пострадавшего в основном зависит от общего объема кровопотери и быстроты скопления крови в полости перикарда с развитием тампонады сердца (при малых раневых отверстиях), от которой ряд пострадавших погибает до поступления в хирургический стационар. В случаях, когда перикардиальный дефект велик, кровь из небольшой раны свободно вытекает в плевральную полость или наружу, не вызывая механического затруднения работы С. Особенно тяжелые расстройства сердечной деятельности возникают при повреждении венечных артерий, проводящей системы, клапанов С., перегородок, сухожильных хорд и сосочковых мышц.
В типичных случаях состояние пострадавших в момент осмотра тяжелое. Пострадавшие обычно испытывают чувство страха, беспокойства, предъявляют жалобы на резкую слабость, боль в области С., ощущение нехватки воздуха и затрудненное дыхание. Входное отверстие обычно локализуется на передней поверхности левой половины грудной клетки в пределах от II ребра до реберной дуги между парастернальной и средней подмышечной линиями. Возможны и другие локализации ран, включая верхнюю половину живота. У раненого отмечают резкую бледность кожи, холодный пот, частый малый пульс, сниженное АД. При постоянном истечении крови из перикарда в плевральную полость тоны С. не изменены или немного ослаблены; отмечаются укорочение перкуторного звука над легкими и ослабление дыхания на стороне поражения. Повреждение клапанного аппарата или перегородок С. сопровождается возникновением над областью интенсивного систолического шума.
В случае развития тампонады С. кожа у раненого бледно-серая или синюшная, дыхание частое, поверхностное, отмечается заметное вздутие шейных вен. Пульс малого наполнения или совсем не пальпируется, систолическое АД ниже критического уровня (70 мм рт. ст.), диастолическое не определяется, резко возрастает центральное венозное давление (до 200—300 мм вод ст.). Границы С. равномерно увеличены в поперечнике, тоны ослаблены или вообще не выслушиваются. При срочном рентгенологическом исследовании выявляют расширение границ С., сглаженность его контуров, отсутствие или снижение пульсации по контурам сердечной ткани. Для уточнения диагноза производят пункцию перикарда.
В ряде случаев точное представление о локализации повреждения миокарда дает сопоставление с клинической картиной электрокардиографических данных. На ЭКГ в отведениях, отражающих локализацию повреждения, отмечаются изменения, как при инфаркте миокарда: снижение вольтажа зубцов ЭКГ, смещение сегмента SТ вверх или вниз от изолинии, сглаживание или инверсия зубца Т, иногда глубокий зубец Q, зазубренность и расширение комплекса QRS, указывающие на нарушение внутрижелудочковой проводимости. Для диагностики повреждений венечных сосудов, клапанного аппарата и перегородок С. важно своевременное проведение рентгеноконтрастного исследования (коронарография, вентрикулография).
Лечебная тактика при открытых повреждениях С. строится из необходимости проведения срочной операции ушивания раны. Поэтому первой задачей является экстренная доставка пострадавшего в хирургическое отделение при ограничении объема помощи на догоспитальном этапе (в процессе транспортировки раненого) только мероприятиями по поддержанию жизненно важных функций организма. Успех оперативного вмешательства зависит от своевременности поступления раненого в лечебное учреждение и быстроты выполнения торакотомии при полноценной предоперационной подготовке. Тяжелое состояние пострадавшего не должно останавливать хирурга.
Предоперационная подготовка в случаях установленного диагноза осуществляется в кратчайшие сроки: необходимая неотложная терапия проводится перед наркозом и продолжается параллельно с оперативным вмешательством. Обязательным условием является пункция перикарда с целью максимального удаления из него крови. При наличии гемопневмоторакса перед операцией необходимо дренировать плевральную полость с обязательной реинфузией крови. Операцию проводят под общей анестезией. Наиболее принятым доступом является левосторонняя переднебоковая торакотомия в четвертом или пятом межреберье. После вскрытия плевральной полости края раны широко разводят ранорасширителем и вскрывают перикард, быстро удаляя из его полости кровь. Рану находят по пульсирующей струе крови на передней или боковой поверхности С. Кровотечение временно останавливают пальцевым прижатием раны и осторожно проводят ревизию задней поверхности С. На рану С. накладывают швы, оберегая венечные сосуды, т.к. их перевязка приводит к тяжелой ишемии миокарда. В случаях небольших ранений венечных артерий необходимо наложение сосудистого шва (см. Кровеносные сосуды). Более значительные повреждения основных артериальных ветвей С. требуют аутовенозного аортокоронарного шунтирования с целью восстановления миокардиального кровотока. Перикард ушивают редкими отдельными швами. В плевральную полость через прокол в седьмом— восьмом межреберье по среднемышечной линии вводят эластический дренаж с просветом большого диаметра. После расправления легкого рану грудной стенки зашивают послойно наглухо. Больные с приобретенными травматическими пороками С. (дефекты перегородки, недостаточность клапанного аппарата) нуждаются в реконструктивных операциях с применением искусственного кровообращения (Искусственное кровообращение).
В послеоперационном периоде особое внимание уделяют поддержанию адекватной гемодинамики, газообмена и профилактике инфекционных осложнений. Всем пострадавшим назначают анальгетики, антибиотики, проводят оксигенотерапию, восполняют объем циркулирующей плазмы; при необходимости вводят стероидные гормоны. Тщательно следят за сохранением проводимости дыхательных путей, своевременно удаляя мокроту из трахеи.
Прогноз зависит от тяжести повреждения и своевременности оказания помощи.
Заболевания. Нарушения процессов метаболизма в миокарде вследствие расстройств их регуляции и воздействия на С. различных патогенных факторов (токсико-химические, инфекционные и др.) могут вести к развитию миокардиодистрофии (Миокардиодистрофия), иногда к дегенеративным его изменениям (например, при Амилоидозе). Особой группой болезней неясной этиологии являются Кардиомиопатии.
Воспалительные процессы могут поражать одновременно все оболочки сердца (см. Панкардит) или преимущественно какую-либо одну из них (см. Миокардит, Перикардит, Эндокардит). Наиболее частая причина воспалительных заболеваний С. — Ревматизм. Тяжелые поражения эндокарда клапанов С., обусловленные последствиями их ревматического воспаления, чаще всего ведут к формированию приобретенных пороков С., хотя иногда их причиной служат и другие патологические процессы, например атеросклероз, сифилис, инфаркт миокарда, травма. Если эндокардит чаще всего носит ревматический характер, то миокардит нередко возникает и в результате других патогенных воздействий: токсических, вирусных, микробных, инфекционно-аллергических, паразитарных и др. Причинами перикардита наряду с ревматизмом могут быть вирусная инфекция, туберкулез, сифилис. Своеобразный асептический перикардит развивается в остром периоде инфаркта миокарда, а также при постинфарктном синдроме (Постинфарктный синдром). В части случаев воспалительно-аллергические поражения С. относятся к проявлениям диффузных заболеваний соединительной ткани (Диффузные заболевания соединительной ткани). Тяжелые дистрофические и воспалительные поражения миокарда могут приводить к возникновению очагов некроза с их последующей организацией и исходом в Кардиосклероз, который может быть причиной постоянных нарушений сердечного ритма, проводимости, развития сердечной недостаточности (Сердечная недостаточность). В некоторых случаях отсутствие каких бы то ни было признаков поражения миокарда или экстракардиальной патологии заставляет признать имеющиеся у больного нарушения ритма С. идиопатическими, т.е. самостоятельной болезнью (см. Аритмии сердца, Блокада сердца, Мерцательная аритмия, Пароксизмальная тахикардия, Экстрасистолия). Крупный очаг кардиосклероза с резким локальным истончением миокарда приводит к формированию аневризмы сердца (Аневризма сердца).
Различные патогенные воздействия на С. возникают нередко при заболеваниях других органов. Эти воздействия могут носить гуморальный или нейрогуморальный (например при гипоталамических поражениях) характер. Возможно прорастание опухолей легких или органов средостения в С.; иногда наблюдается также метастазирование в С. различных опухолей. Острая или хроническая перегрузка правого желудочка при повышении сопротивления кровотоку в малом круге кровообращения служит причиной развития легочного сердца (Лёгочное сердце).
Заболевания сердца в Международной классификации болезней, травм и причин смерти IX пересмотра включены в раздел «Болезни органов кровообращения». Действительно, в ряде случаев трудно провести грань между болезнями С. и сосудов. Так, при васкулитах с вовлечением венечных артерий, при ишемической болезни сердца (Ишемическая болезнь сердца) его поражения развиваются вторично по отношению к сосудистым нарушениям (см. Коронарит, Коронарная недостаточность). К заболеваниям органов кровообращения относится и широко распространенная Гипертоническая болезнь, при которой поражения С. также носят вторичный характер.
Психические расстройства при заболеваниях С. встречаются нередко, особенно у больных с инфарктом миокарда, лиц с приобретенными и врожденными пороками С., а также у больных, перенесших операции на С., в послеоперационном периоде. При сердечно-сосудистой декомпенсации часто возникают астенические и неврозоподобные состояния. Они включают расстройства сна, аппетита, депрессивно-дистимические расстройства настроения, страхи, истериформные и сенестопатически-ипохондрические проявления. Изредка возникают острые Симптоматические психозы с выраженным тревожно-депрессивным компонентом. У части больных они могут носить затяжной характер (до 1—3 мес.). У больных с приобретенными пороками С. наблюдаются вторичные невротические реаакции: депрессивные, тревожно-ипохондрические реже истероневротические. У некоторых больных, особенно с эпилептоидными и тревожно-мнительными чертами характера, возможно патологическое развитие личности депрессивно-ипохондрического типа.
Психические нарушения у больных с врожденными пороками С. чаще наблюдаются при пороках синего типа. Наряду с астенически неврозоподобными состояниями часто отмечаются различные нарушения психического развития: Инфантилизм психический, патологическое формирование личности, задержка интеллектуального развития, реже Олигофрения.
Осложнения операций на С. в случаях выраженной церебральной гипоксии, как правило, сопровождаются затяжными (до 2 мес. и более) астеническими и неврозоподобными состояниями. В ближайшем послеоперационном периоде возможно возникновение кратковременных острых симптоматических психозов. Изредка у больных с ревматическими пороками С. наблюдаются затяжные (до 2—3 мес.) послеоперационные психозы с преобладанием депрессивно-бредовых расстройств. В отдельных случаях при недостаточной эффективности операции и сопутствующих психотравмирующих ситуациях у больных с приобретенными пороками С. возникают «поздние депрессии» с суицидальными попытками. Осложненные операции по поводу врожденных пороков С. могут сопровождаться помимо цереброастенических и неврозоподобных расстройств временным или стойким усилением психоорганических нарушений.
Диагноз основывается на тесной зависимости психических нарушений от изменений соматического состояния. Дифференциальный диагноз с шизофренией (Шизофрения) необходим в основном в случаях затяжных психозов у больных с приобретенными пороками С., а также при затяжных послеоперационных психозах. Эпилептиформный синдром у больных с пороками С. дифференцируют с эпилепсией (Эпилепсия).
Лечение направлено прежде всего на основное заболевание. Психофармакологические средства назначает психиатр по согласованию с кардиологом. При астенических и неврозоподобных расстройствах применяют транквилизаторы (хлозепид, сибазон), а также нейролептики мягкого действия (тиоридазин) и антидепрессанты (амитриптилин, алимемазин). Острые психозы купируют парентеральным введением нейролептиков (аминазин, левомепромазин) При затяжных психозах назначают курсовое лечение нейролептиками (галоперидол, трифлуперидол) в сочетании с антидепрессантами (амитриптилин, имизин). Вторичные невротические реакции и патологическое развитие личности требуют применения различных видов психотерапии (Психотерапия).
Опухоли сердца разделяют на первичные, к которым относятся доброкачественные и злокачественные новообразования, исходящие из тканей С. и перикарда, и вторичные — злокачественные опухоли, исходящие из внесердечных тканей, но метастазирующие в перикард и мышцу С. Ложными опухолями С. иногда называют организованные внутриполостные тромбы, имеющие опухолевидную конфигурацию и сходные с опухолями сердца клинические проявления. По локализации различают опухоли перикарда миокарда и эндокарда: выделяют также внутриполостные и внутристеночные новообразования.
Первичные опухоли сердца встречаются очень редко, по частоте преобладают доброкачественные опухоли С., в частности миксома, рабдомиома и гемангиома.
Миксома составляет около 50% всех доброкачественных опухолей С. Обычно она развивается из эндокарда предсердий и имеет макроскопически вид полипов или папилломатозных разрастаний на ножке величиной от 1 до 12 см, располагающихся в левом, иногда в правом предсердии.
Клиническая картина зависит от степени обтурации опухолью предсердно-желудочковою отверстия. При миксоме левого предсердия наиболее типична клиническая картина, соответствующая проявлениям митрального стеноза в сочетании с длительным субфебрилитетом, анемией, диспротеинемией и нередко повторной артериальной эмболией элементами опухоли. Среди клинических проявлений возможны упорный кашель с кровохарканьем, обмороки, отек легких (Отёк легких). При аускультации С. часто обнаруживаются, как и при митральном стенозе, усиление I тона сердца, диастолический шум в точке Боткина и акцент II тона над легочным стволом. Диагностика затруднена, нередко устанавливают ошибочный диагноз ревматического порока С., также часто протекающего с субфебрилитетом, повышением СОЭ. В дифференциальной диагностике с митральным стенозом помогают особенности диастолического шума (при миксоме он чаще не имеет пресистолического усиления, ограничиваясь прото- и мезодиастолой) и в ряде случаев выраженная динамика шума и громкости I тона при изменениях положения тела больного. Для уточнения диагноза используют контрастирование полостей С. углекислым газом, радиоизотопное сканирование, перфузионную сцинтиграфию миокарда, ангиокардиографию, однако наиболее информативным и нетравматичным методом диагностики является эхокардиография. При миксоме левого предсердия эхокардиографически под передней створкой митрального клапана регистрируется эхо-сигнал в виде «облака», занимающий 3/4 или всю диастолу. Этот эффект связан с баллотированием опухоли в предсердно-желудочковом отверстии при сокращениях сердца. В левом предсердии в момент систолы определяется эхо-сигнал, имеющий характерный вид «монетных столбиков». Большое значение для обнаружения миксомы С. имеет секторальное ультразвуковое сканирование. Лечение оперативное. Успешно выполненная операция обычно всегда приводит к полному выздоровлению.
Рабдомиома составляет около 20% доброкачественных опухолей сердца и, как и гемангиома, чаще встречается у детей. Клинические проявления рабдомиомы и гемангиомы С. зависят от величины и локализации. При больших размерах опухоли наблюдаются аритмии и сердечная недостаточность. Для диагностики этих опухолей применяют те же методы, что и для выявления миксом.
Злокачественными первичными опухолями являются саркома С. и мезотелиома перикарда. Цинически саркома С. проявляется быстро «регрессирующей сердечной недостаточностью, которая становится обычно причиной смерти больного. При жизни это заболевание почти не диагностируется. Мезотелиома развивается из мезотелия серозной оболочки, поражает оба листка перикарда и может врастать в миокард. Клинически протекает в виде экссудативного перикардита. Диагностируется с помощью рентгенографии и рентгенокимографии С., электро- и эхокардиографии, а также компьютерной томографии. Лечение оперативное.
Вторичные опухоли сердца встречаются чаще, чем первичные. Они обнаруживаются более чем у 5% умерших от онкологических заболеваний: при раке легкого, опухолевых заболеваниях кроветворной ткани, раке молочной железы и меланоме. Различают крупноузловые и мелкоузловые метастазы в С. Крупные узлы диаметром до 1 до 5 см имеют вид округлых образований с довольно четкими границами и располагаются в разных участках С. значительно выступая над поверхностью и изменяя его конфигурацию, или вид полипов, вдаваясь в полости С. Мелкоузловые метастазы диаметром от 1 до 10 мм чаще бывают рассеяны по перикарду и эпикарду, реже по миокарду.
Клинические проявления метастазов злокачественных опухолей в С. зависят от их величины и локализации и нередко перекрываются симптомами поражения других органов, а также симптомами общей интоксикации. Характерной особенностью клинической картины крупноузловых метастазов в миокард является быстро прогрессирующая, рефракторная к лечению сердечная недостаточность в сочетании с различными нарушениями сердечного ритма. Крупные полипообразные метастазы, располагающиеся в полостях С., могут вызывать появление патологических шумов, имитирующих аускультативную картину порока сердца.
Важными для диагностики распространения опухолевого процесса на миокард могут быть изменения ЭКГ, имитирующие инфаркт миокарда и другие проявления острого нарушения коронарного кровообращения без последующей положительной их динамики. Рентгенологически могут быть обнаружены увеличение сердечной тени, ее многоконтурность. С помощью эхокардиографии выявляют зоны акинезии или гиперкинезии. Мелкоузловые метастазы, не нарушая гемодинамики, в большинстве случаев не имеют четкой клинической симптоматики. При метастатическом поражении перикарда чаще, чем при других формах опухолевого поражения С., развиваются экссудативный перикардит с симптомами сердечной недостаточности. Наиболее информативным для диагностики прорастания опухоли в перикард и миокард является сочетание таких признаков, как упорная боль в области С., шум трения перикарда и синдром сдавления верхней полой вены. Не распознанный своевременно опухолевый перикардит приводит к тампонаде С. с быстрым прогрессированием сердечной недостаточности и может явиться непосредственной причиной смерти больного.
Распознавание вторичного опухолевого поражения перикарда у онкологических больных основывается на симптомах острого перикардита (фибринозного, выпотного, констриктивного), быстро нарастающем увеличении сердечной тени на рентгенограммах в сочетании с уменьшением вольтажа желудочковых комплексов на ЭКГ, появлении эхонегативного пространства в области задней стенки левого желудочка, обнаружении атипических клеток при цитологическом исследовании жидкости, полученной при пункции перикарда. Возможности эхокардиографической диагностики метастазов и прорастания опухоли в перикард и мышцу С. ограничены. Можно выявить лишь метастазы, расположенные в полостях С. или в области задней стенки левого желудочка, иногда в межжелудочковой перегородке. Метастазы опухоли в перикард или миокард также создают эхонегативное пространство, но в отличие от перикардиального выпота оно наблюдается не на всем протяжении, а на ограниченном участке.
Лечение вторичных опухолей С. проводят на фоне комплексной терапии первичной опухоли. При накоплении в перикарде значительного количества экссудата показана многократная его эвакуация или постоянное дренирование полости перикарда с введением в нее противоопухолевых средств.
Операции
Хирургические вмешательства на сердце до середины 20 в. ограничивались в основном операциями при его ранениях (ушивание раны) и в связи с заболеваниями перикарда (иссечение сращений при сдавливающем перикардите, удаление опухолей и кист); начиная с 20-х гг. выполнялись отдельные операции при некоторых пороках С. Развитие и становление кардиохирургии как самостоятельного направления в лечении различных заболеваний С. начались главным образом во второй половине 20 в. после внедрения в клиническую практику аппарата искусственного кровообращения (см. Искусственное кровообращение), позволившего выполнять операции на открытом С., а также кардиоплегических растворов, защищающих миокард от необратимых гипоксических повреждений. К 80-м гг. достаточно широко выполнялись реконструктивные операции при многих врожденных пороках С. и основные виды хирургического лечения приобретенных пороков С. — комиссуротомия при клапанных стенозах (закрытая и открытая), пластические операции на клапанах (ануло- и вальвулопластика), Протезирование клапанов сердца; получили развитие хирургические методы лечения ишемической болезни С. и ее осложнений (аортокоронарное шунтирование, иссечение аневризмы С.), некоторых аритмий С. (деструкция проводящих путей и др.); был накоплен опыт успешных операции пересадки сердца (см. Трансплантация). Без применения искусственного кровообращения в настоящее время проводится относительно ограниченное число операций на С., в частности закрытые комиссуротомии, перикардэктомия и иссечение кист перикарда, большинство вмешательств по поводу проникающих ранений С. нарушений его ритма, перевязка артериального протока. Такие сложные вмешательства, как резекция аневризмы С., различные варианты, аортокоронарного шунтирования, протезирование клапанов С. и магистральных сосудов, коррекция сложных врожденных пороков, а также пересадка С., выполняются в условиях искусственного кровообращения и холодовой кардиоплегии.
Операции при врожденных пороках С. подразделяют на радикальные и паллиативные; последние направлены на улучшение гемодинамики и общего состояния пациента без ликвидации самого порока. Радикальные операции, устраняющие порок и восстанавливающие нормальную гемодинамику, не всегда возможны, выполнение тем труднее, чем сложнее порок, чем меньше возраст ребенка. Наиболее часто проводятся такие радикальные операции, как вскрытие артериального протока (рис. 29), различные виды реконструкции аорты при ее коарктации (рис. 30, 31), ликвидация клапанного стеноза легочного ствола (рис. 32), пластика дефектов межпредсердной (рис. 33, 34) и межжелудочковой (рис. 35) перегородок. Выполнение этих операций в большинстве случаев может быть отложено до достижения ребенком возраста 3—5 лет и больше, однако немалую долю (от 20 до 30%) составляют сложные пороки при которых дети с момента рождения находятся в критическом состоянии, требующем интенсивной терапии и проведения операции, хотя бы паллиативной, в течение первого года развития. Паллиативные операции могут осуществляться как в форме окончательного вмешательства при данном пороке, так и в качестве первого этапа хирургического лечения, позволяющего улучшить общее состояние ребенка и создать более благоприятные условия для последующего выполнения радикальной операции. Нельзя надолго откладывать операцию при пороках с прогрессирующей легочной гипертензией, т.к. при высокой ее степени, когда давление в легочном стволе и в аорте выравнивается, хирургическое лечение порока становится нецелесообразным и считается противопоказанным.
Операции при приобретенных пороках серца — см. Пороки сердца приобретенные (Пороки сердца приобретённые).
Хирургическое лечение при окклюзии венечных артерий сердца — см. Ишемическая болезнь сердца.
Библиогр.: Вагнер Е.А. Хирургия повреждений груди, М., 1981; Инструментальные методы исследования сердечно-сосудистой системы, под ред. Т.С. Виноградовой, М., 1986; Михайлов С.С. Клиническая анатомия сердца, М., 1987, библиогр.; Рентгенодиагностика заболеваний сердца и сосудов, под ред. М.А. Иваницкой, М., 1970; Руководство по кардиологии, под ред. Е.И. Чазова, т. 1, 2, 3, М., 1982; Сердечно-сосудистая хирургия, под ред. В.И. Бураковского и Л.А. Бокерия, М., 1989.
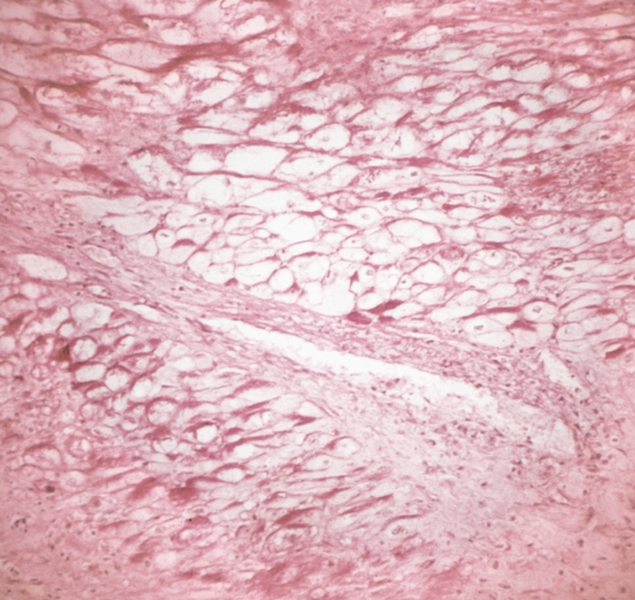 гликоген (гранулы красного цвета); ШИК-реакция; ×100">
гликоген (гранулы красного цвета); ШИК-реакция; ×100">Рис. 10. Микропрепарат сердца с миоцитолизом: опустошение цитоплазмы кардиомиоцитов (светлые ячейки); в некоторых клетках сохранен гликоген (гранулы красного цвета); ШИК-реакция; ×100.
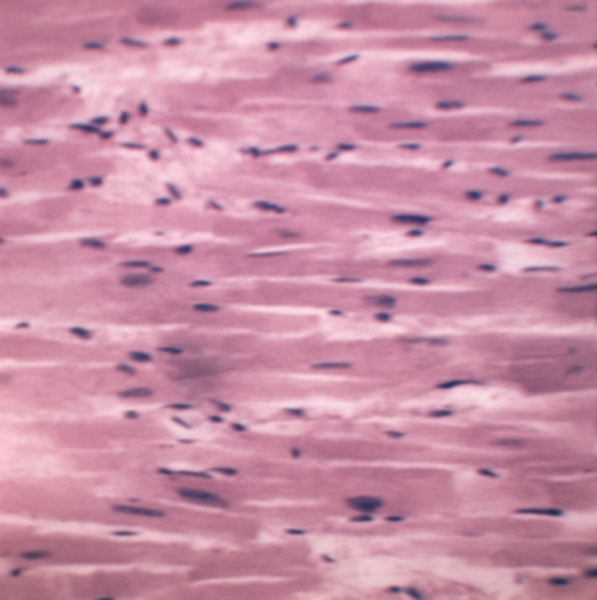 окраска гематоксилином и эозином; ×180">
окраска гематоксилином и эозином; ×180">Рис. 5. Микропрепарат нормального миокарда: видны параллельно расположенные мышечные волокна; окраска гематоксилином и эозином; ×180.
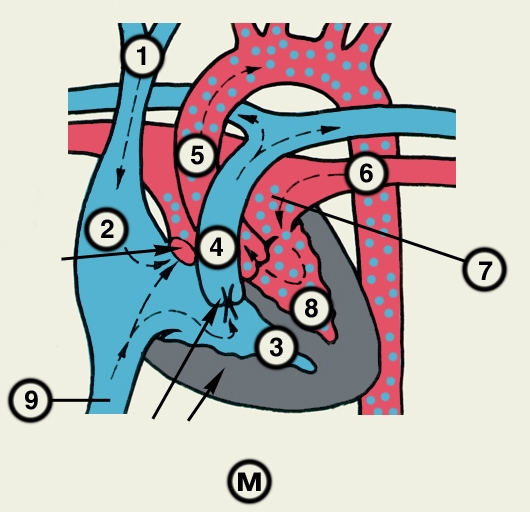 локализация пороков — сплошными стрелками): триада Фалло — стеноз легочного ствола, дефект межпредсердной перегородки и гипертрофия правого желудочка; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена">
локализация пороков — сплошными стрелками): триада Фалло — стеноз легочного ствола, дефект межпредсердной перегородки и гипертрофия правого желудочка; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена">Рис. 23м). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): триада Фалло — стеноз легочного ствола, дефект межпредсердной перегородки и гипертрофия правого желудочка; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена.
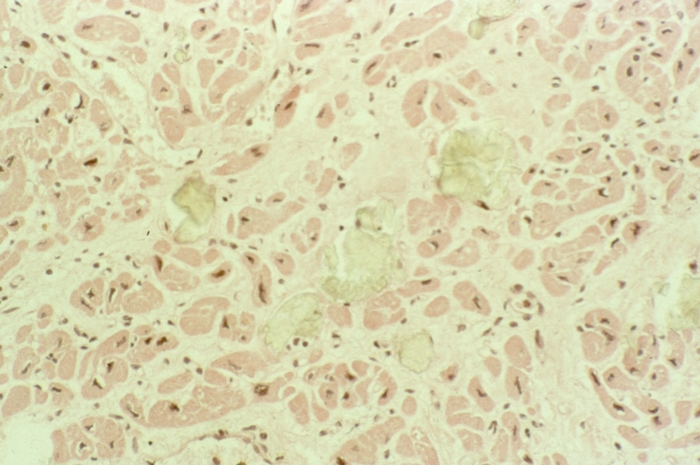 оксалоз), рядом с которым определяются гигантские клетки инородных тел; вокруг скопления кристаллов видна нежная рубцовая ткань и слабо выраженные явления миокардита; окраска гематоксилином и эозином; ×320">
оксалоз), рядом с которым определяются гигантские клетки инородных тел; вокруг скопления кристаллов видна нежная рубцовая ткань и слабо выраженные явления миокардита; окраска гематоксилином и эозином; ×320">Рис. 13. Микропрепарат сердца при отравлении этиленгликолем: в интерстициальной ткани миокарда видно розеткообразное скопление зеленовато-желтых кристаллов щавелевой кислоты (оксалоз), рядом с которым определяются гигантские клетки инородных тел; вокруг скопления кристаллов видна нежная рубцовая ткань и слабо выраженные явления миокардита; окраска гематоксилином и эозином; ×320.
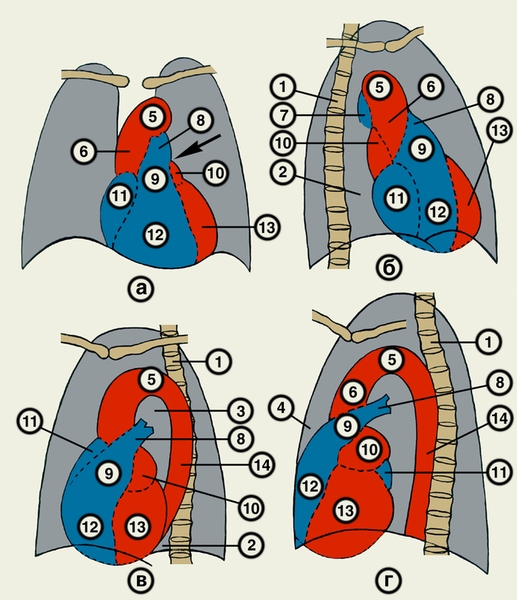 позвоночник; 2 — ретрокардиальное пространство; 3 — аортальное окно; 4 — ретростернальное пространство; 5 — дуга аорты; 6 — восходящая аорта; 7 — верхняя полая вена; 8 — легочный ствол; 9 — легочный конус; 10 — левое предсердие; 11 — правое предсердие; 12 — правый желудочек; 13 — левый желудочек; 14 — нисходящая аорта; жирными черными линиями обозначены дуги контура тени сердца, образованные соответствующими его отделами; пунктирными линиями обозначены границы между отделами; стрелкой указана талия сердца">
позвоночник; 2 — ретрокардиальное пространство; 3 — аортальное окно; 4 — ретростернальное пространство; 5 — дуга аорты; 6 — восходящая аорта; 7 — верхняя полая вена; 8 — легочный ствол; 9 — легочный конус; 10 — левое предсердие; 11 — правое предсердие; 12 — правый желудочек; 13 — левый желудочек; 14 — нисходящая аорта; жирными черными линиями обозначены дуги контура тени сердца, образованные соответствующими его отделами; пунктирными линиями обозначены границы между отделами; стрелкой указана талия сердца">Рис. 22. Схемы рентгеновского изображения сердца и крупных сосудов в прямой (а), правой (первой) косой (б), левой (второй) косой (в) и левой боковой (г) проекциях: 1 — позвоночник; 2 — ретрокардиальное пространство; 3 — аортальное окно; 4 — ретростернальное пространство; 5 — дуга аорты; 6 — восходящая аорта; 7 — верхняя полая вена; 8 — легочный ствол; 9 — легочный конус; 10 — левое предсердие; 11 — правое предсердие; 12 — правый желудочек; 13 — левый желудочек; 14 — нисходящая аорта; жирными черными линиями обозначены дуги контура тени сердца, образованные соответствующими его отделами; пунктирными линиями обозначены границы между отделами; стрелкой указана талия сердца.
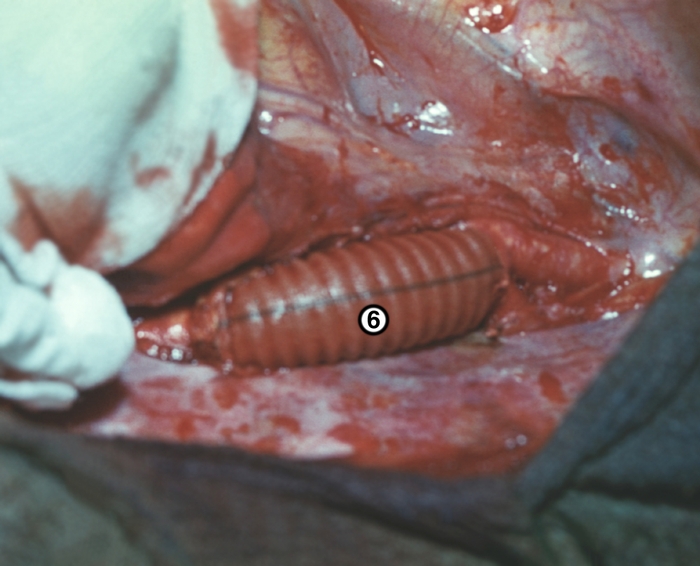 плевра, выделены и взяты на лигатуры дуга аорты (2), левая сонная артерия (3), левая подключичная артерия (4), а также участок нисходящей грудной аорты с коарктацией (5) в типичном месте (сужение в форме «песочных часов»), замененный на следующем этапе операции синтетическим протезом (6)">
плевра, выделены и взяты на лигатуры дуга аорты (2), левая сонная артерия (3), левая подключичная артерия (4), а также участок нисходящей грудной аорты с коарктацией (5) в типичном месте (сужение в форме «песочных часов»), замененный на следующем этапе операции синтетическим протезом (6)">Рис. 30б). Этапы операции по поводу коарктации аорты: протезирование. Доступом через левую плевральную полость (левое легкое отжато салфеткой — 1) вскрыта медиастинальная плевра, выделены и взяты на лигатуры дуга аорты (2), левая сонная артерия (3), левая подключичная артерия (4), а также участок нисходящей грудной аорты с коарктацией (5) в типичном месте (сужение в форме «песочных часов»), замененный на следующем этапе операции синтетическим протезом (6).
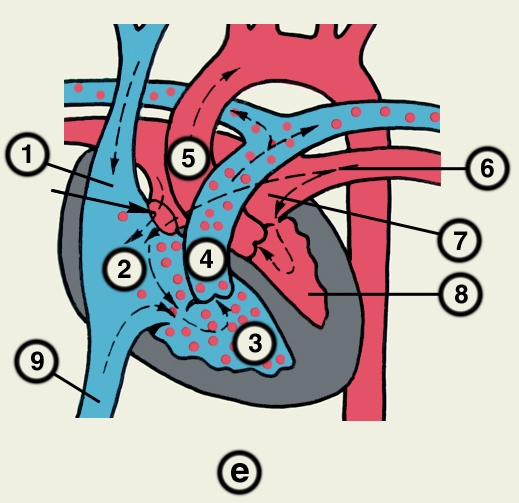
Рис. 23е). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): дефект межпредсердной перегородки; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена.
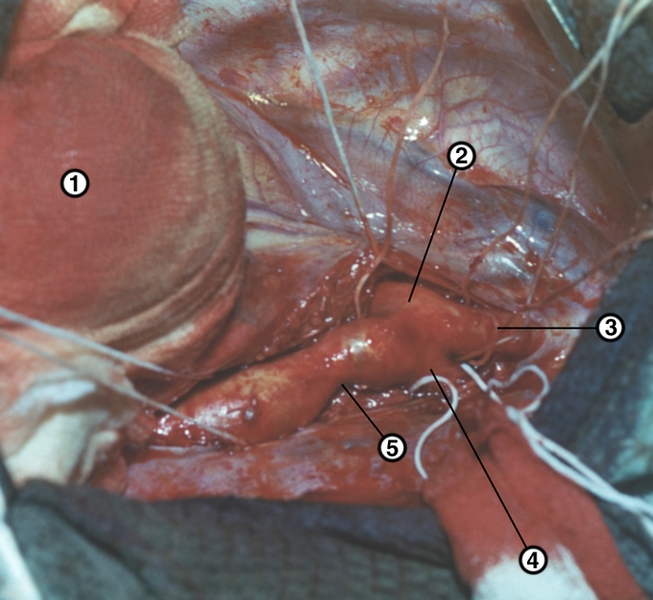 выделение аорты. Доступом через левую плевральную полость (левое легкое отжато салфеткой — 1) вскрыта медиастинальная плевра, выделены и взяты на лигатуры дуга аорты (2), левая сонная артерия (3), левая подключичная артерия (4), а также участок нисходящей грудной аорты с коарктацией (5) в типичном месте (сужение в форме «песочных часов»), замененный на следующем этапе операции синтетическим протезом (6)">
выделение аорты. Доступом через левую плевральную полость (левое легкое отжато салфеткой — 1) вскрыта медиастинальная плевра, выделены и взяты на лигатуры дуга аорты (2), левая сонная артерия (3), левая подключичная артерия (4), а также участок нисходящей грудной аорты с коарктацией (5) в типичном месте (сужение в форме «песочных часов»), замененный на следующем этапе операции синтетическим протезом (6)">Рис. 30а). Этапы операции по поводу коарктации аорты: выделение аорты. Доступом через левую плевральную полость (левое легкое отжато салфеткой — 1) вскрыта медиастинальная плевра, выделены и взяты на лигатуры дуга аорты (2), левая сонная артерия (3), левая подключичная артерия (4), а также участок нисходящей грудной аорты с коарктацией (5) в типичном месте (сужение в форме «песочных часов»), замененный на следующем этапе операции синтетическим протезом (6).
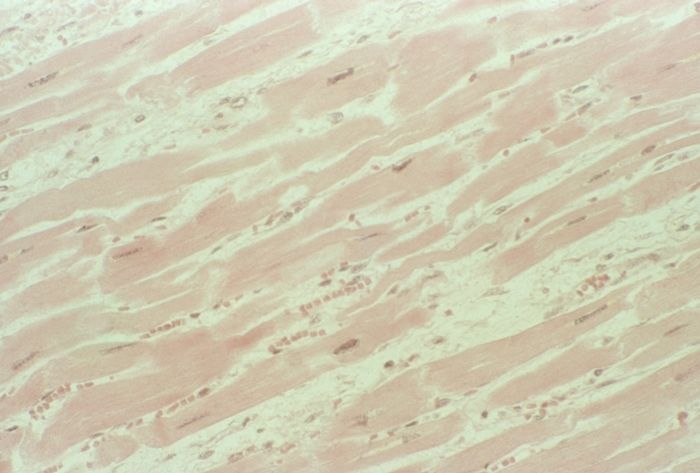 капилляры, мышечные волокна фрагментированы, поперечная исчерченность их не выражена, воспалительный инфильтрат скуден; окраска гематоксилином и эозином; ×320">
капилляры, мышечные волокна фрагментированы, поперечная исчерченность их не выражена, воспалительный инфильтрат скуден; окраска гематоксилином и эозином; ×320">Рис. 17. Микропрепарат сердца при дифтерийном миокардите: в миокарде многочисленные мелкие очаги молодой соединительной ткани (на месте погибших миофибрилл), в которых сохраняются резко расширенные капилляры, мышечные волокна фрагментированы, поперечная исчерченность их не выражена, воспалительный инфильтрат скуден; окраска гематоксилином и эозином; ×320.
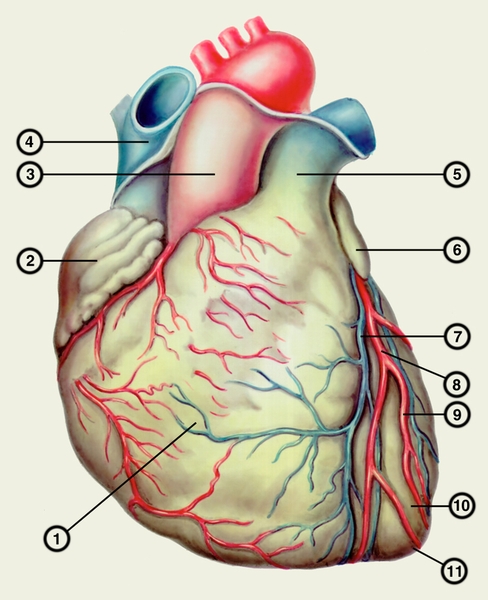 Вид сердца спереди: 1 — правый желудочек; 2 — правое ушко; 3 — восходящая часть аорты; 4 — верхняя полая вена; 5 — легочный ствол; 6 — левое ушко; 7 — большая вена сердца; 8 — передняя межжелудочковая ветвь левой венечной артерии; 9 — передняя межжелудочковая борозда; 10 — левый желудочек; 11 — верхушка сердца">
Вид сердца спереди: 1 — правый желудочек; 2 — правое ушко; 3 — восходящая часть аорты; 4 — верхняя полая вена; 5 — легочный ствол; 6 — левое ушко; 7 — большая вена сердца; 8 — передняя межжелудочковая ветвь левой венечной артерии; 9 — передняя межжелудочковая борозда; 10 — левый желудочек; 11 — верхушка сердца">Рис. 1. Вид сердца спереди: 1 — правый желудочек; 2 — правое ушко; 3 — восходящая часть аорты; 4 — верхняя полая вена; 5 — легочный ствол; 6 — левое ушко; 7 — большая вена сердца; 8 — передняя межжелудочковая ветвь левой венечной артерии; 9 — передняя межжелудочковая борозда; 10 — левый желудочек; 11 — верхушка сердца.
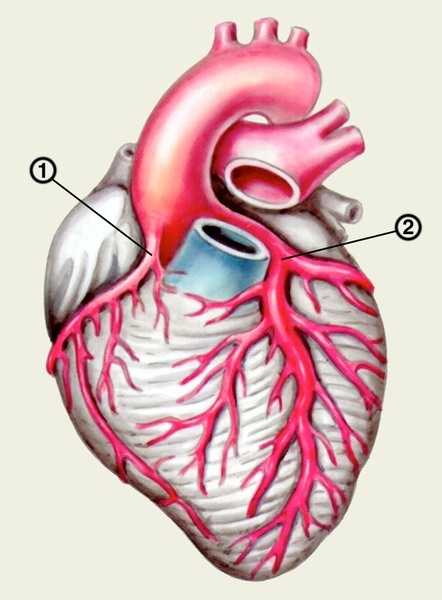
Рис. 7. Сердце с левовенечным типом кровоснабжения: левая венечная артерия (2) и ее ветви более развиты, чем правая венечная артерия (1).
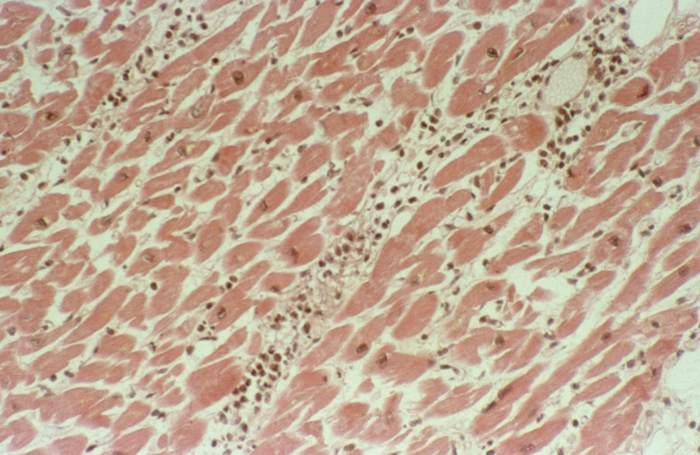
Рис. 19. Микропрепарат сердца при вторичном миокардите в связи с передозировкой карбимазола и эутирокса при лечении тиреотоксикоза: в интерстициальной ткани миокарда видны очаговые и диффузные инфильтраты, состоящие преимущественно из нейтрофилов с примесью плазмоцитов и эозинофильных гранулоцитов, в мышечных волокнах дистрофические изменения; окраска гематоксилином и эозином; ×320.
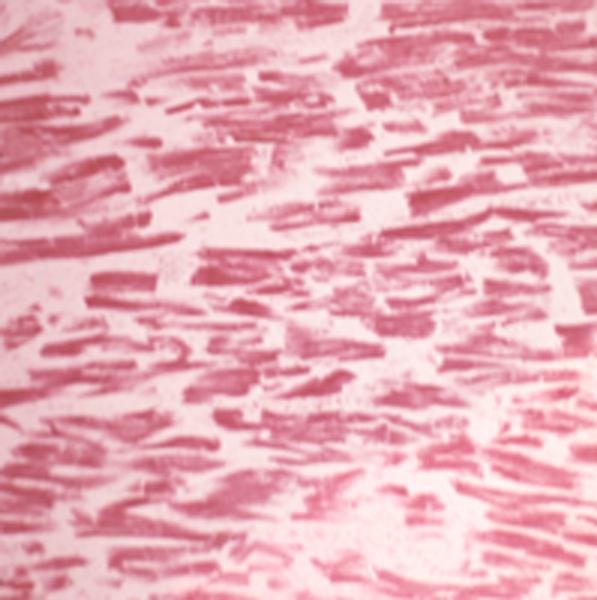
Рис. 12. Микропрепарат сердца с фрагментацией мышечных волокон миокарда: все поля зрения занимают разорванные на отдельные сегменты мышечные волокна; окраска по Маллори; ×100.
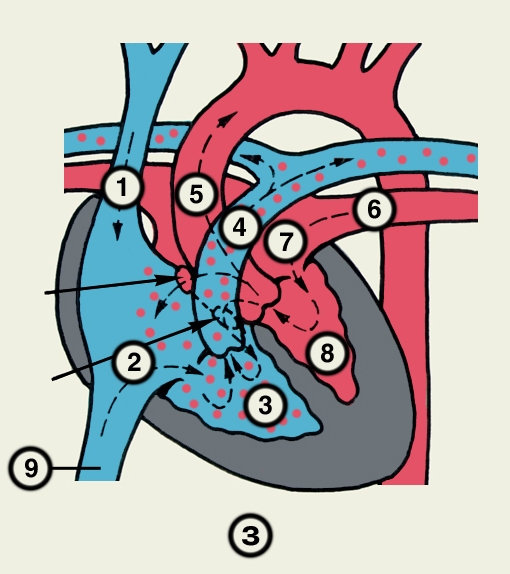
Рис. 23з). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): прорыв аневризмы синуса Вальсальвы; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена.
 Доступ к перегородке через правое предсердие (1), края дефектов (2) прошиты атравматическими П-образными швами (3), в центре решетчатого дефекта видна разделяющая его мембрана (4); блики (5) в просвете дефектов соответствуют поверхности крови в полости левого предсердия, уровень которой во время операции во избежание воздушной эмболии поддерживают не ниже межпредсердной перегородки">
Доступ к перегородке через правое предсердие (1), края дефектов (2) прошиты атравматическими П-образными швами (3), в центре решетчатого дефекта видна разделяющая его мембрана (4); блики (5) в просвете дефектов соответствуют поверхности крови в полости левого предсердия, уровень которой во время операции во избежание воздушной эмболии поддерживают не ниже межпредсердной перегородки">Рис. 33б). Операция по поводу решетчатого дефекта межпредсердной перегородки, выполняемые на работающем сердце (видны магистрали аппарата искусственного кровообращения). Доступ к перегородке через правое предсердие (1), края дефектов (2) прошиты атравматическими П-образными швами (3), в центре решетчатого дефекта видна разделяющая его мембрана (4); блики (5) в просвете дефектов соответствуют поверхности крови в полости левого предсердия, уровень которой во время операции во избежание воздушной эмболии поддерживают не ниже межпредсердной перегородки.
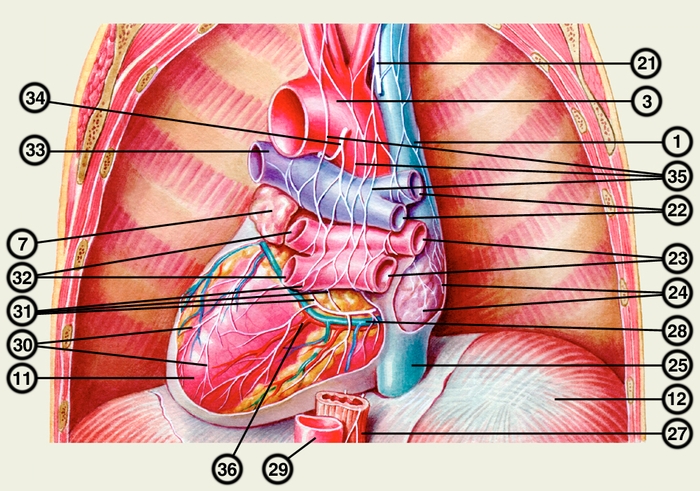 диафрагма; 13 — эпикард; 14 — переднее правое нервное сплетение (желудочка); 15 — правый желудочек; 16 — правая венечная артерия; 17 — перикард (отвернут); 18 — правое ушко; 19 — поверхностная часть сердечного сплетения; 20 — правое легкое; 21 — правый блуждающий нерв (отсечен); 22 — ветви правой легочной артерии; 23 — правые легочные вены; 24 — часть правого заднего нервного сплетения; 25 — нижняя полая вена; 26 — левое предсердие; 27 — пищевод (отсечен); 28 — венечный синус; 29 — грудная часть аорты (отсечена); 30 — задние левое и правое нервные сплетения (желудочков); 31 — заднее нервное сплетение предсердий; 32 — левые легочные вены; 33 — левая легочная артерия; 34 — левый гортанный возвратный нерв (отсечен); 35 — глубокая часть сердечного сплетения; 36 — задняя межжелудочковая ветвь правой венечной артерии">
диафрагма; 13 — эпикард; 14 — переднее правое нервное сплетение (желудочка); 15 — правый желудочек; 16 — правая венечная артерия; 17 — перикард (отвернут); 18 — правое ушко; 19 — поверхностная часть сердечного сплетения; 20 — правое легкое; 21 — правый блуждающий нерв (отсечен); 22 — ветви правой легочной артерии; 23 — правые легочные вены; 24 — часть правого заднего нервного сплетения; 25 — нижняя полая вена; 26 — левое предсердие; 27 — пищевод (отсечен); 28 — венечный синус; 29 — грудная часть аорты (отсечена); 30 — задние левое и правое нервные сплетения (желудочков); 31 — заднее нервное сплетение предсердий; 32 — левые легочные вены; 33 — левая легочная артерия; 34 — левый гортанный возвратный нерв (отсечен); 35 — глубокая часть сердечного сплетения; 36 — задняя межжелудочковая ветвь правой венечной артерии">Рис. 4б). Схематическое изображение сердца (с нервами и сосудами) в грудной полости (вид сзади, перикард, эпикард и легкие удалены): 1 — верхняя полая вена; 2 — левый диафрагмальный нерв; 3 — дуга аорты; 4 — левый блуждающий нерв; 5 — легочный ствол; 6 — нервно-узловое поле правого желудочка (в зоне артериального конуса); 7 — левое ушко; 8 — передняя межжелудочковая ветвь левой венечной артерии; 9 — большая вена сердца: 10 — переднее левое нервное сплетение (желудочка); 11 — левый желудочек; 12 — диафрагма; 13 — эпикард; 14 — переднее правое нервное сплетение (желудочка); 15 — правый желудочек; 16 — правая венечная артерия; 17 — перикард (отвернут); 18 — правое ушко; 19 — поверхностная часть сердечного сплетения; 20 — правое легкое; 21 — правый блуждающий нерв (отсечен); 22 — ветви правой легочной артерии; 23 — правые легочные вены; 24 — часть правого заднего нервного сплетения; 25 — нижняя полая вена; 26 — левое предсердие; 27 — пищевод (отсечен); 28 — венечный синус; 29 — грудная часть аорты (отсечена); 30 — задние левое и правое нервные сплетения (желудочков); 31 — заднее нервное сплетение предсердий; 32 — левые легочные вены; 33 — левая легочная артерия; 34 — левый гортанный возвратный нерв (отсечен); 35 — глубокая часть сердечного сплетения; 36 — задняя межжелудочковая ветвь правой венечной артерии.
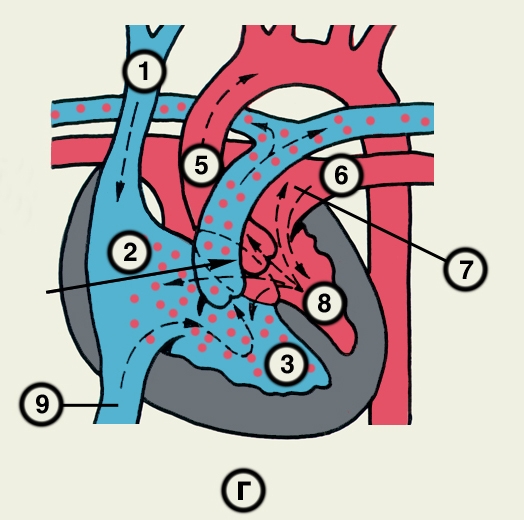
Рис. 23г). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): атриовентрикулярный канал (полная форма) — патологическое сообщение между предсердиями и желудочками, формирующееся в результате сочетания дефектов межпредсердной и межжелудочковой перегородок с деформацией атриовентрикулярных клапанов; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена.
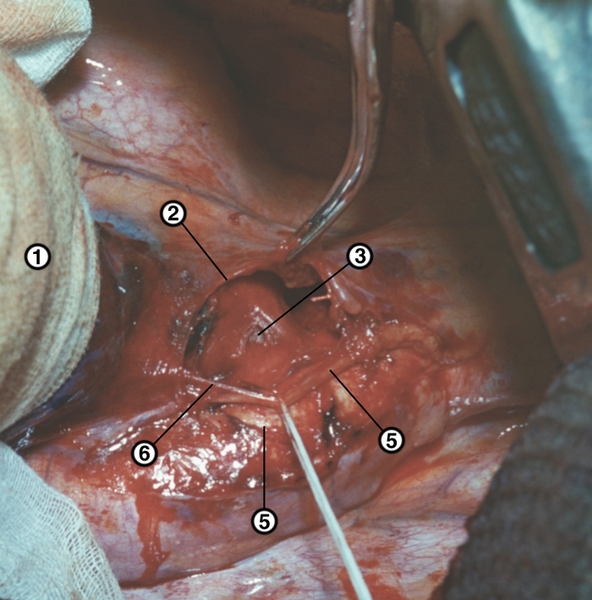 перевязки открытого артериального протока. Доступ через левую плевральную полость, левое легкое отжато салфеткой (1), вскрытием медиастинальной плевры (2) обнажен широкий открытый артериальный проток (3), лигатурой отведен в сторону блуждающий нерв (4), лежащий на аорте (5), под нижний полюс протока уходит возвратный нерв (6), являющийся ориентиром для выделения протока перед его перевязкой">
перевязки открытого артериального протока. Доступ через левую плевральную полость, левое легкое отжато салфеткой (1), вскрытием медиастинальной плевры (2) обнажен широкий открытый артериальный проток (3), лигатурой отведен в сторону блуждающий нерв (4), лежащий на аорте (5), под нижний полюс протока уходит возвратный нерв (6), являющийся ориентиром для выделения протока перед его перевязкой">Рис. 29. Этап операции перевязки открытого артериального протока. Доступ через левую плевральную полость, левое легкое отжато салфеткой (1), вскрытием медиастинальной плевры (2) обнажен широкий открытый артериальный проток (3), лигатурой отведен в сторону блуждающий нерв (4), лежащий на аорте (5), под нижний полюс протока уходит возвратный нерв (6), являющийся ориентиром для выделения протока перед его перевязкой.
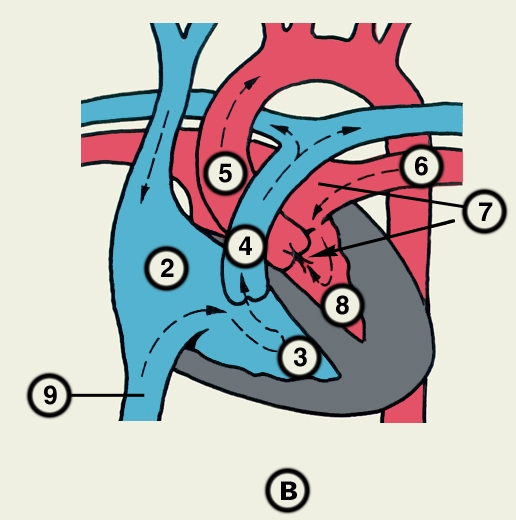
Рис. 23в). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): аортальный стеноз; 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена.

Рис. 35б). Этапы операции по поводу дефекта межжелудочковой перегородки: этап закрытия дефекта синтетической заплатой (4), которая прошивается атравматическими П-образными швами.
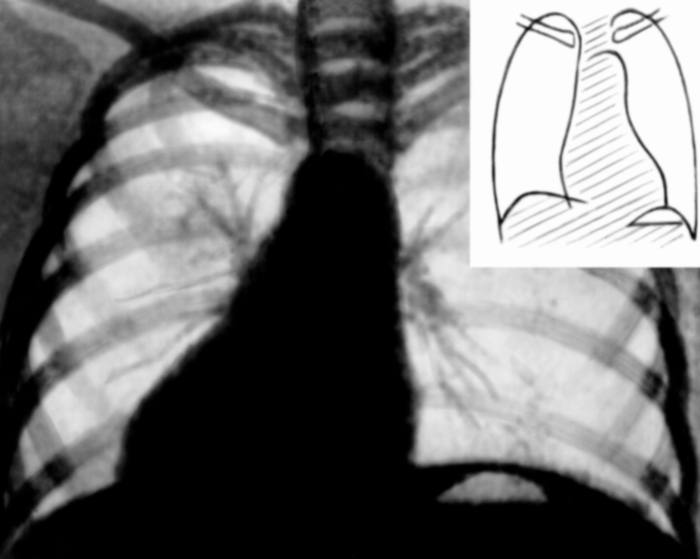 Рентгенограмма грудной клетки (прямая проекция) при зеркальной декстрокардии. Справа вверху — схема рентгенограммы при нормальном расположении сердца">
Рентгенограмма грудной клетки (прямая проекция) при зеркальной декстрокардии. Справа вверху — схема рентгенограммы при нормальном расположении сердца">Рис. 24. Рентгенограмма грудной клетки (прямая проекция) при зеркальной декстрокардии. Справа вверху — схема рентгенограммы при нормальном расположении сердца.
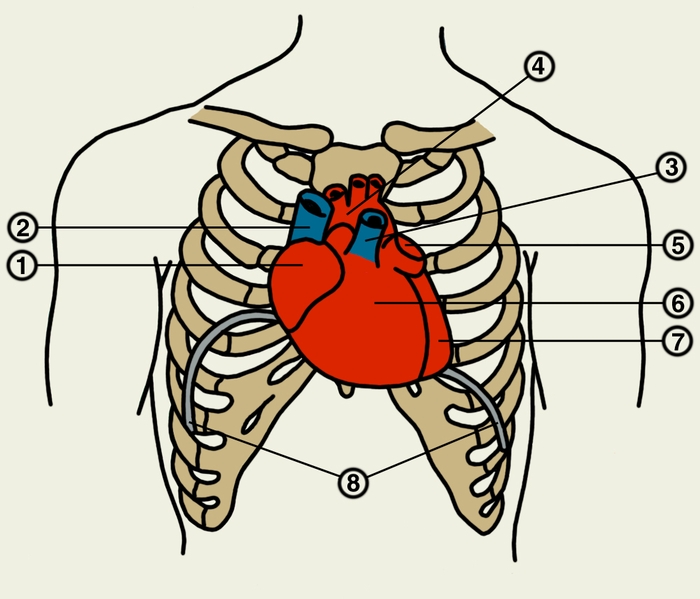
Рис. 3. Схематические изображение проекции отделов сердца, крупных сосудов и куполов диафрагмы на переднюю стенку грудной клетки: 1 — правое предсердие; 2 — верхняя полая вена; 3 — легочный ствол; 4 — дуга аорты; 5 — левое ушко; 6 — правый желудочек; 7 — левый желудочек; 8 — правый и левый куполы диафрагмы.
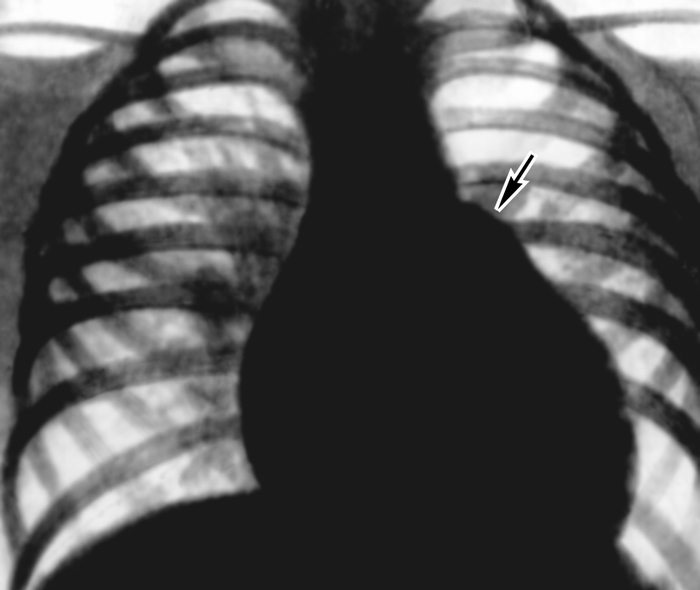
Рис. 26. Рентгенограмма грудной клетки больного с дефектом межжелудочковой перегородки (прямая проекция): тень сердца увеличена за счет обоих желудочков, заметное выбухание дуги легочного ствола (указано стрелкой), легочный рисунок в прикорневых отделах легких усилен.
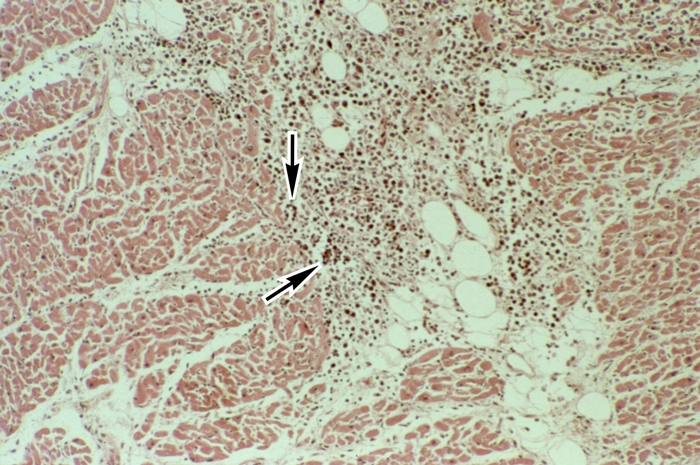
Рис. 21. Микропрепарат сердца при грибовидном микозе миокарда: среди мышечных волокон виден массивный инфильтрат, состоящий из больших лимфоидных клеток и многоядерных «микозных» клеток (указаны стрелками); окраска гематоксилином и эозином; ×320.
Рис. 33а). Операция по поводу сплошного дефекта межпредсердной перегородки, выполняемые на работающем сердце (видны магистрали аппарата искусственного кровообращения). Доступ к перегородке через правое предсердие (1), края дефектов (2) прошиты атравматическими П-образными швами (3), в центре решетчатого дефекта видна разделяющая его мембрана (4); блики (5) в просвете дефектов соответствуют поверхности крови в полости левого предсердия, уровень которой во время операции во избежание воздушной эмболии поддерживают не ниже межпредсердной перегородки.
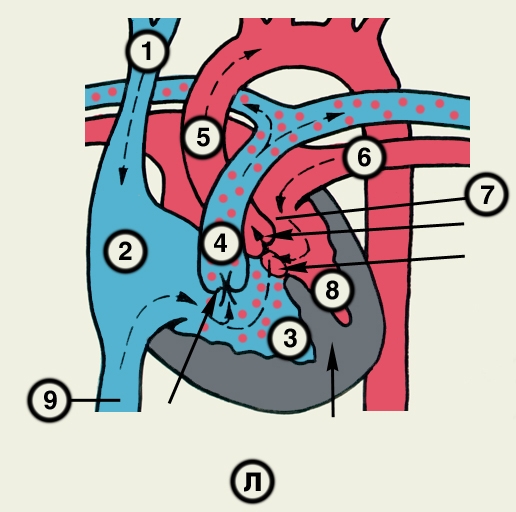
Рис. 23л). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): тетрада Фалло — стеноз легочного ствола, сочетающийся с декстропозицией аорты, дефектом межжелудочковой перегородки и гипертрофией правого желудочка; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена.
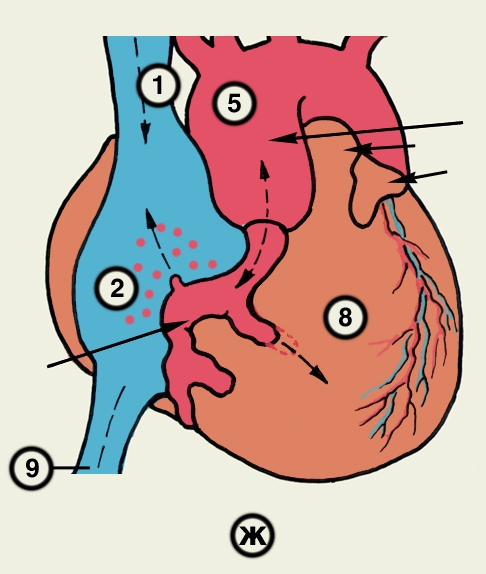
Рис. 23ж). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): коронарно-сердечный свищ — аневризматическое расширение венечной (правой) артерии (вследствие заброса крови из полости сердца); 1 — верхняя полая вена, 2 — правое предсердие, 5 — аорта, 8 — левый желудочек, 9 — нижняя полая вена.
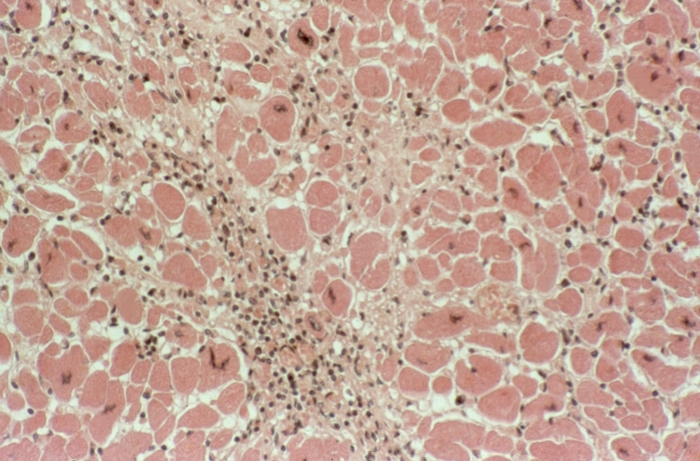
Рис. 18. Микропрепарат сердца при протозойном миокардите Шагаса: в миокарде очаговые и диффузные инфильтраты, состоящие из лимфоцитов и гранулоцитов, небольшого количества эозинофилов и отдельных плазматических клеток; в инфильтрате и вокруг инфильтратов видны нежные соединительнотканные волокна, миофибриллы гипертрофированы; окраска гематоксилином и эозином; ×320.
Рис. 28. Рентгенограмма грудной клетки больного при полной форме атриовентрикулярного канала (прямая проекция): контуры сердца округлой формы за счет увеличения правых и левых отделов.
Рис. 11. Микропрепарат сердца при метаболическом некрозе миокарда: виден фуксинофильный (красного цвета) некротический очаг; окраска по Маллори; ×100.
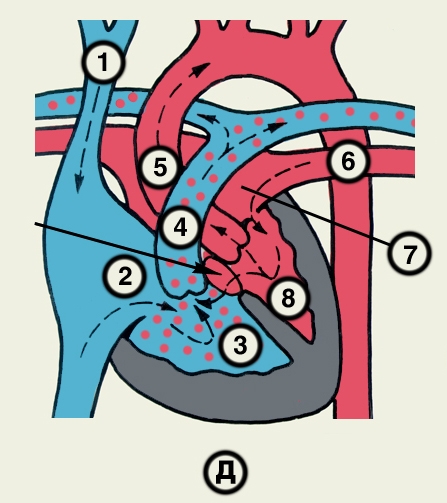
Рис. 23д). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): дефект межжелудочковой перегородки; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек.
Рис. 34. Этап пластики дефекта межпредсердной перегородки со стороны правого предсердия: заплата из тефлона (1) прошита П-образными атравматическими швами (2) и опущена на дефект.
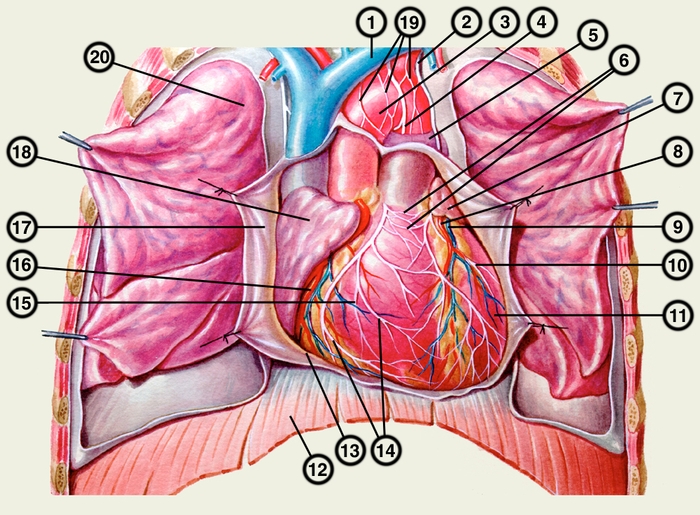
Рис. 4 а). Схематическое изображение сердца (с нервами и сосудами) в грудной полости (вид спереди, полость перикарда вскрыта, эпикард частично удален, легкие оттянуты крючками); 1 — верхняя полая вена; 2 — левый диафрагмальный нерв; 3 — дуга аорты; 4 — левый блуждающий нерв; 5 — легочный ствол; 6 — нервно-узловое поле правого желудочка (в зоне артериального конуса); 7 — левое ушко; 8 — передняя межжелудочковая ветвь левой венечной артерии; 9 — большая вена сердца: 10 — переднее левое нервное сплетение (желудочка); 11 — левый желудочек; 12 — диафрагма; 13 — эпикард; 14 — переднее правое нервное сплетение (желудочка); 15 — правый желудочек; 16 — правая венечная артерия; 17 — перикард (отвернут); 18 — правое ушко; 19 — поверхностная часть сердечного сплетения; 20 — правое легкое.
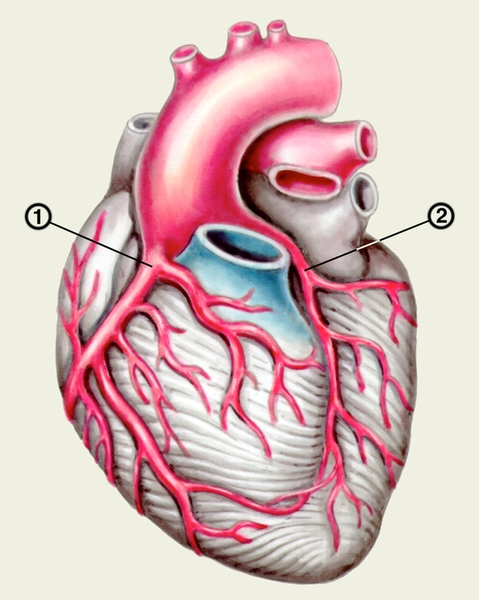
Рис. 6. Сердце с правовенечным типом кровоснабжения: правая венечная артерия (1) и ее ветви более развиты, чем левая венечная артерия (2).
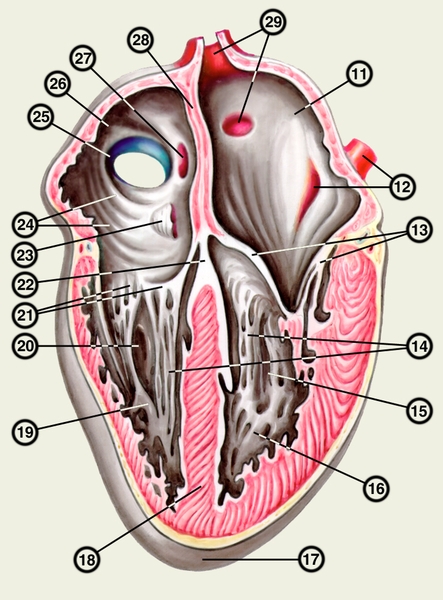 фронтальный разрез, вид спереди): 11 — левое предсердие; 12 — левая легочная вена; 13 — митральный клапан; 14 — сухожильные хорды; 15 — левый желудочек; 16 — мясистые трабекулы; 17 — верхушка сердца; 18 — желудочковая перегородка (мышечная часть); 19 — сосочковые мышцы; 20 — правый желудочек; 21 — трехстворчатый клапан; 22 — межжелудочковая перегородка (перепончатая часть); 23 — заслонка венечного синуса; 24 — гребенчатые мышцы; 25 — нижняя полая вена; 36 — правое предсердие; 27 — овальная ямка; 28 — межпредсердная перегородка; 29 — правые легочные вены">
фронтальный разрез, вид спереди): 11 — левое предсердие; 12 — левая легочная вена; 13 — митральный клапан; 14 — сухожильные хорды; 15 — левый желудочек; 16 — мясистые трабекулы; 17 — верхушка сердца; 18 — желудочковая перегородка (мышечная часть); 19 — сосочковые мышцы; 20 — правый желудочек; 21 — трехстворчатый клапан; 22 — межжелудочковая перегородка (перепончатая часть); 23 — заслонка венечного синуса; 24 — гребенчатые мышцы; 25 — нижняя полая вена; 36 — правое предсердие; 27 — овальная ямка; 28 — межпредсердная перегородка; 29 — правые легочные вены">Рис. 2б). Вид сердца на разрезах (фронтальный разрез, вид спереди): 11 — левое предсердие; 12 — левая легочная вена; 13 — митральный клапан; 14 — сухожильные хорды; 15 — левый желудочек; 16 — мясистые трабекулы; 17 — верхушка сердца; 18 — желудочковая перегородка (мышечная часть); 19 — сосочковые мышцы; 20 — правый желудочек; 21 — трехстворчатый клапан; 22 — межжелудочковая перегородка (перепончатая часть); 23 — заслонка венечного синуса; 24 — гребенчатые мышцы; 25 — нижняя полая вена; 36 — правое предсердие; 27 — овальная ямка; 28 — межпредсердная перегородка; 29 — правые легочные вены.
Рис. 27. Рентгенограмма грудной клетки при дефекте межпредсердной перегородки (прямая проекция): увеличение правых отделов сердца, выбухание дуги легочного ствола по левому контуру тени сердца (указано стрелкой); признаки гиперволемии сосудов легких.
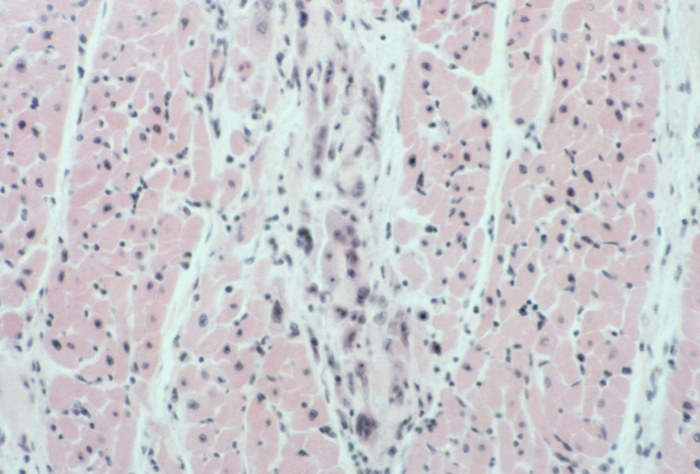
Рис. 15. Микропрепарат сердца при ревматическом миокардите: в интерстиции миокарда видна гранулема Ашоффа — Талалаева, состоящая из крупных мононуклеарных клеток; мышечные волокна гипертрофированы; окраска гематоксилином и эозином; ×320.
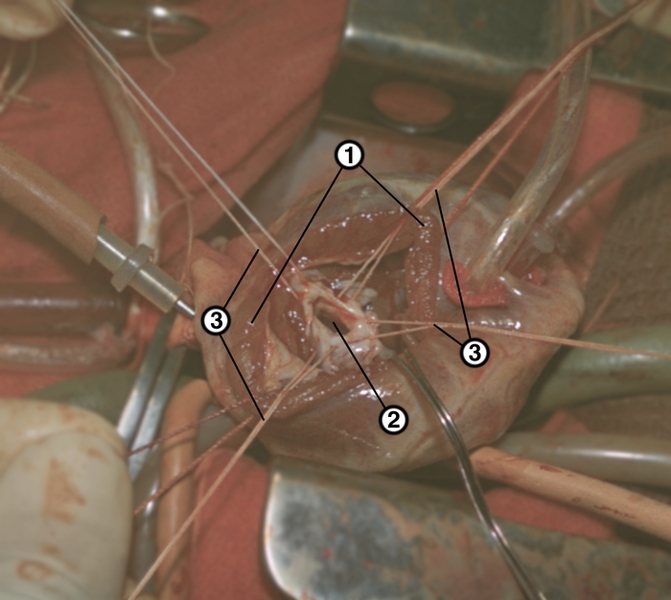
Рис. 35а). Этапы операции по поводу дефекта межжелудочковой перегородки: продольное вскрытие выводного тракта правого желудочка, края разреза (1) разведены швами-держалками, в просвете виден дефект перегородки (2), на края которого наложены атравматические П-образные швы (3), используемые в последующем для фиксации заплаты.
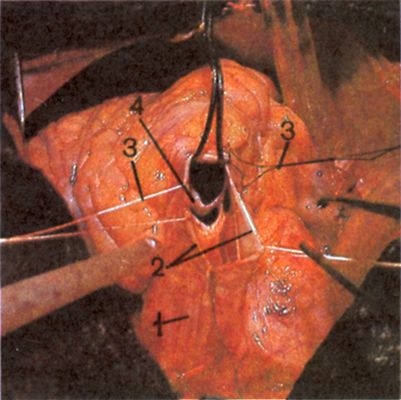
Рис. 32а). Этапы операции комиссуротомии по поводу клапанного стеноза легочного ствола (выполняется на работающем сердце в условиях гипотермии с кратковременным прекращением венозного притока): вскрытие продольным разрезом легочного ствола (1), края которого (2) прошиты и разведены атравматическими швами-держалками (3); в просвете ствола виден деформированный клапан (4) с малодифференцированными створками.
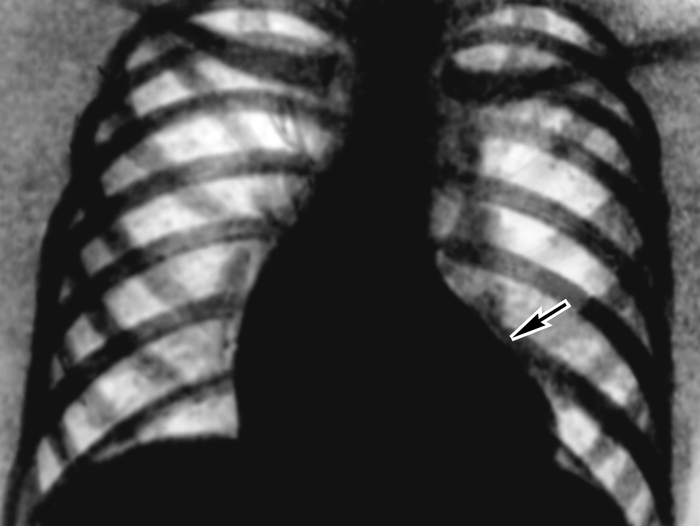
Рис. 25. Рентгенограмма грудной клетки при аортальном стенозе: тень сердца имеет форму башмака (аортальная конфигурация) с увеличенным вследствие гипертрофии левым желудочком (указан стрелкой), верхушка закруглена.
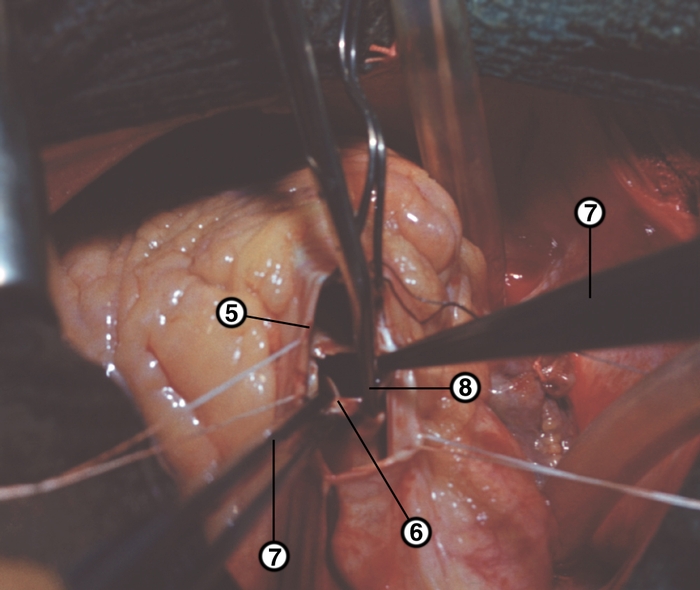 комиссура (8)">
комиссура (8)">Рис. 32б). Этапы операции комиссуротомии по поводу клапанного стеноза легочного ствола (выполняется на работающем сердце в условиях гипотермии с кратковременным прекращением венозного притока): клапан рассечен по одной из комиссур (5), его створки (6) фиксированы пинцетами (7), ножницами рассекается вторая сросшаяся комиссура (8).
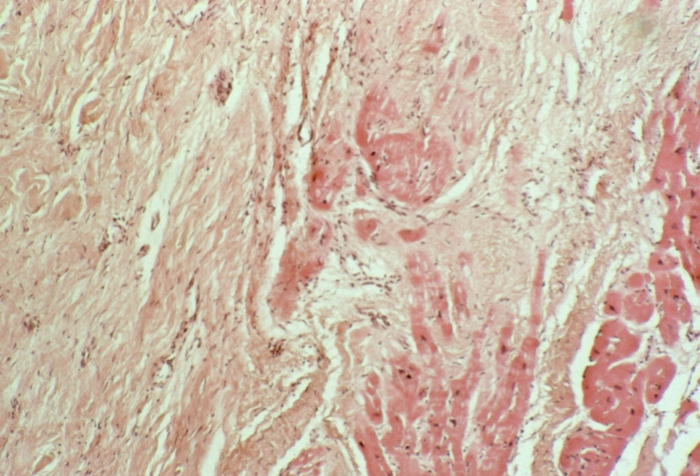
Рис. 20. Микропрепарат фибромы сердца: среди мышечных волокон видна ткань опухоли, состоящая из беспорядочно расположенных, различной толщины пучков соединительной ткани и небольшого количества гистиоцитов; окраска гематоксилином и эозином; ×320.
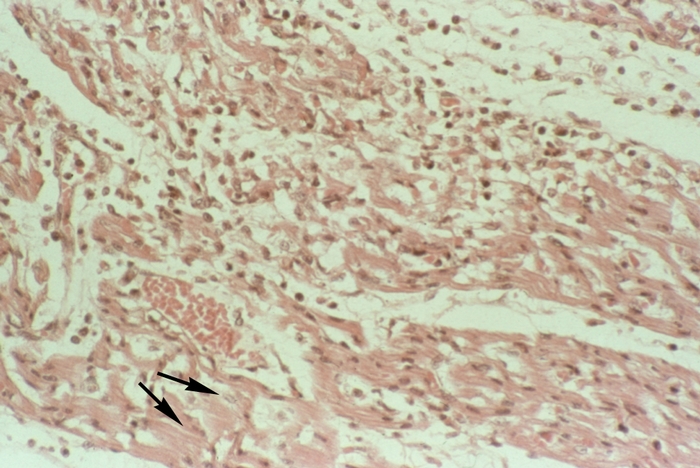
Рис. 16. Микропрепарат сердца при вирусном миокардите: во всех слоях миокарда видны различной величины эозинофильные очаги некроза мышечных волокон (указаны стрелками); выражена фрагментация миофибрилл; между мышечными волокнами — диффузный инфильтрат из лимфоцитов, плазмоцитов, моноцитов, а также эозинофильных и нейтрофильных гранулоцитов; окраска гематоксилином и эозином; ×320.
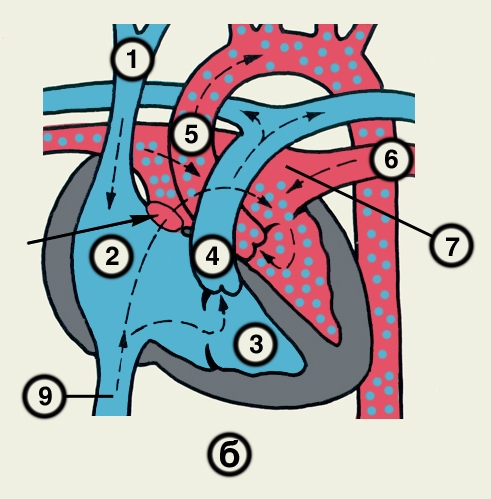
Рис. 23б). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): аномалия Эбштейна — смещение трехстворчатого клапана в сторону правого желудочка, сопровождающееся его деформацией, увеличением полости правого предсердия и уменьшением полости правого желудочка; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 9 — нижняя полая вена.
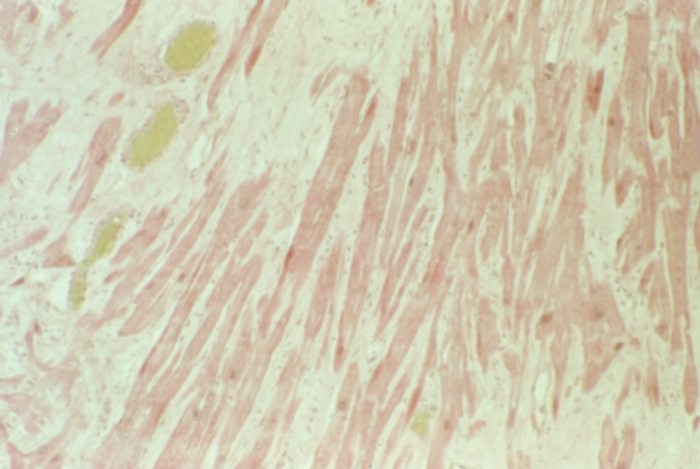
Рис. 8. Микропрепарат сердца при обструктивной гипертрофической кардиомиопатии: в стенке левого желудочка сердца мышечные волокна расположены беспорядочно, многие из них разветвляются, видны завихрения волокон; кардиомиоциты уплотнены, ядра некоторых из них увеличены, вакуолизированы, поперечная исчерченность не выражена; интерстициальная ткань фиброзирована, бедна клеточными элементами, в ней имеются небольшие поля склероза; окраска гематоксилином и эозином; ×120.
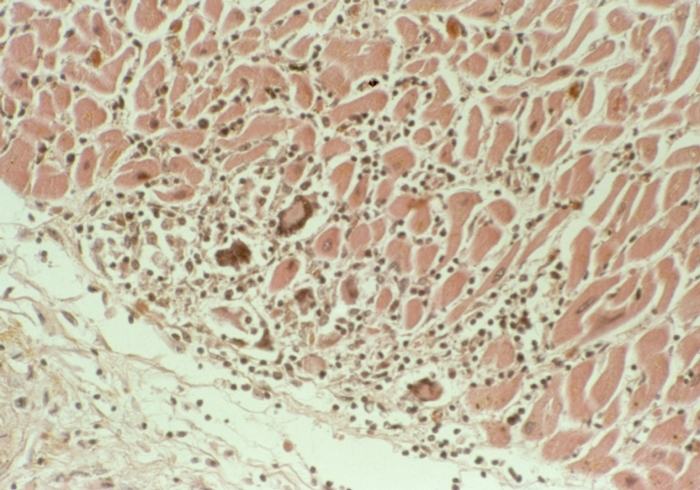
Рис. 14. Микропрепарат сердца при гигантоклеточном миокардите: в миокарде виден диффузный гистоцитарный инфильтрат с небольшим количеством гранулоцитов и гигантскими многоядерными клетками; расширение сосудов микроциркуляторного русла, выраженные дистрофические изменения миофибрилл; окраска гематоксилином и эозином; ×320.
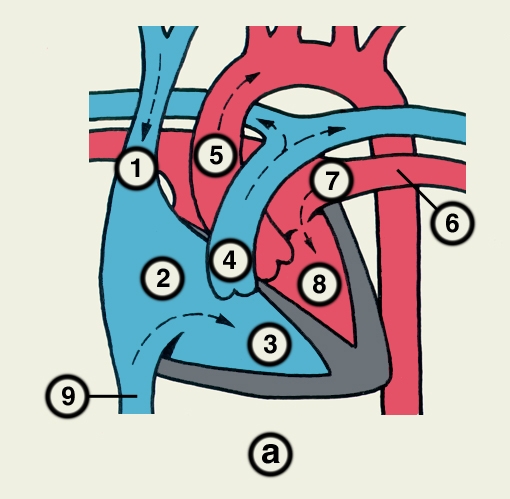 норма; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена">
норма; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена">Рис. 23а). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): норма; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена.
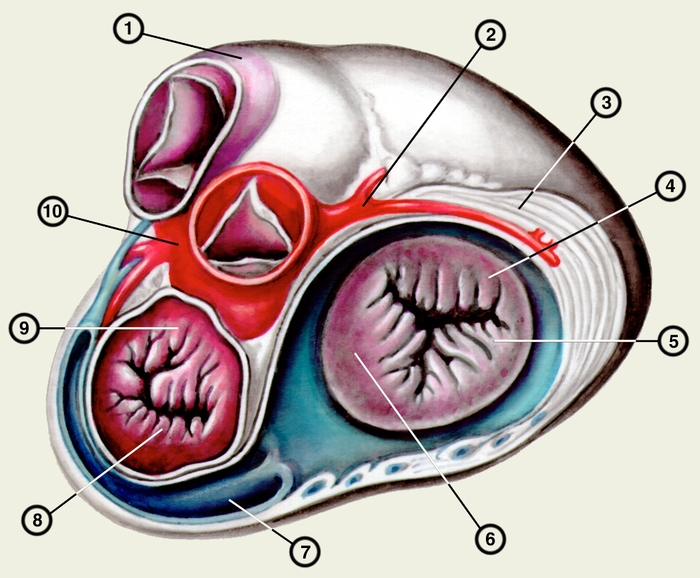
Рис. 2а). Вид сердца на разрезах (поперечный разрез на уровне венечного синуса, вид сверху): 1 — легочный ствол; 2 — аорта; 3 — правая венечная артерия; 4 — средняя створка трехстворчатого клапана; 5 — задняя створка трехстворчатого клапана; 6 — перегородочная створка трехстворчатого клапана; 7 — венечный синус; 8 — задняя створка митрального клапана; 9 — передняя створка митрального клапана; 10 — левая венечная артерия.
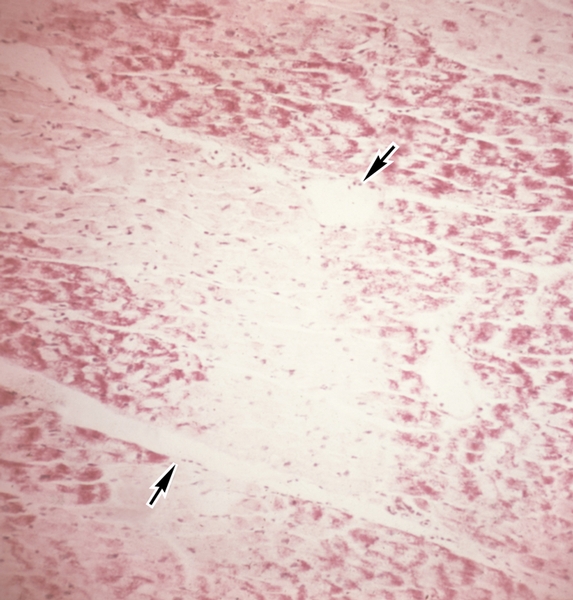
Рис. 9. Микропрепарат сердца при углеводной дистрофии миокарда: стрелками указан крупный очаг сниженного содержания гликогена в кардиомиоцитах; по периферии очага видны кардиомиоциты с гранулами гликогена красного цвета; ШИК-реакция; ×100.
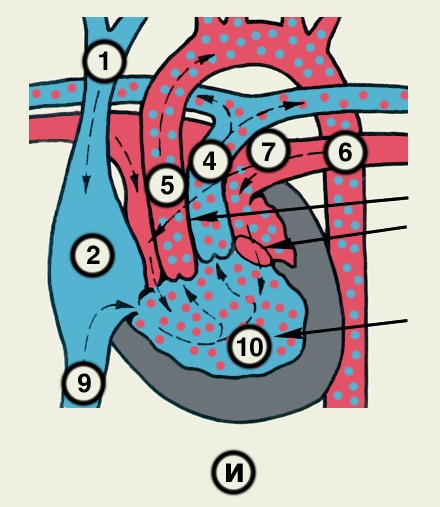
Рис. 23и). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): трехкамерное сердце с единым желудочком; 1 — верхняя полая вена, 2 — правое предсердие, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 9 — нижняя полая вена, 10 — единый желудочек.
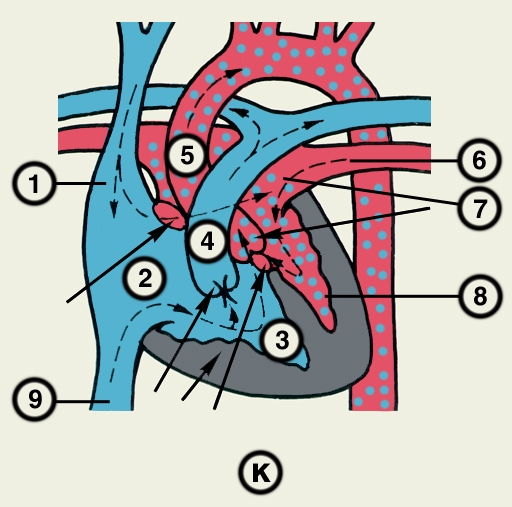
Рис. 23к). Схематическое изображение отдельных врожденных пороков сердца (направления кровотока обозначены пунктирными стрелками, локализация пороков — сплошными стрелками): пентада Фалло — стеноз легочного ствола, сочетающийся с декстропозицией аорты, дефектами межпредсердной, межжелудочковой перегородок и гипертрофией правого желудочка; 1 — верхняя полая вена, 2 — правое предсердие, 3 — правый желудочек, 4 — легочный ствол, 5 — аорта, 6 — легочная вена, 7 — левое предсердие, 8 — левый желудочек, 9 — нижняя полая вена.
Рис. 31. Завершающий этап протезирования нисходящего отдела грудной аорты при сочетании ее коарктации с гипоплазией: в проксимальную часть синтетического протеза (1) имплантирована левая подключичная артерия (2).
II
Се́рдце (cor, PNA, BNA, JNA)
фиброзно-мышечный орган кровеносной системы, расположенный в среднем средостении, в околосердечной сумке и содержащий систему полостей (предсердия и желудочки); сокращения С. обеспечивают продвижение крови по сосудам.
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг.