CHROME
Le chrome (symbole Cr, numéro atomique 24) est un métal placé en tête de la colonne VIa de la classification périodique; il appartient donc à la première famille des éléments de transition. Il a de nombreuses analogies avec le molybdène, le tungstène et l’uranium et quelques analogies avec des éléments de la colonne VIb , en particulier le soufre et le sélénium au degré d’oxydation 6.
Le chrome naturel, de masse atomique 51,996, renferme les isotopes 50 (4,31 p. 100), 52 (83,76 p. 100), 53 (9,55 p. 100) et 54 (2,38 p. 100) non radioactifs.
Tout au long du XIXe siècle, le chrome, caractérisé dans ses minerais et isolé par Vauquelin dès 1798, demeura une curiosité de laboratoire, tandis que ses composés: Cr23, sels de chrome (III), chromates et bichromates prenaient une importance industrielle croissante. Mais lorsque, par aluminothermie, Goldschmidt eut préparé le métal lui-même, le chrome ne tarda pas à jouer, au XXe siècle, un rôle essentiel dans la métallurgie des aciers spéciaux et des aciers inoxydables et dans celle des alliages pour résistances électriques; la découverte des Stellites qui conservent toutes leurs propriétés mécaniques à des températures élevées donna un nouvel essor à cette métallurgie. Il ne faut pas oublier la mise au point du chromage des métaux et alliages; non seulement le chrome assure dans ce cas une protection très efficace contre la corrosion, mais encore il communique aux surfaces ainsi traitées un caractère esthétique.
Les grands producteurs de minerai de chrome sont le Zimbabwe, l’ex-Union soviétique, l’Afrique du Sud et la Turquie.
Historique
C’est en 1798 que Vauquelin isola le chrome métallique, sous forme d’une poudre grise, à partir de la crocoïte ou «plomb rouge», minerai de couleur orange, découvert en Sibérie. Il prépara d’abord l’acide chromique, puis l’oxyde Cr23 qui donnait, avec le borax, des perles vert émeraude. Frappé par les colorations vives des dérivés de ce nouveau métal, Vauquelin proposa le nom de chrome, du grec 﨑福諸猪見 qui signifie couleur.
Kurtz installa, en 1816, à Londres, et en 1822, à Manchester les premières usines préparant des colorants minéraux à base de chrome; en 1818, Zuber créa, en France, la première fabrique de jaune et de vert de chrome pour papiers peints; en 1820, en Allemagne, Köchlin utilisa le bichromate de potassium pour préparer le rouge turc et développa son emploi comme mordant dans la teinture de la laine et du coton.
Aux États-Unis, à partir de 1827, Isaac Tyson découvrit de nombreux gisements de chromite (le meilleur minerai), et développa l’industrie des bichromates et de leurs applications.
En 1844, Péligot publia des travaux importants sur les sels de chrome et, dix ans plus tard, Bunsen prépara le métal par électrolyse du chlorure de chrome (II).
À partir de 1884, Schultz puis, en 1893, Dennis mirent au point le tannage des peaux par les composés basiques du chrome, procédé préconisé par Knapp dès 1858.
À la fin du XIXe siècle, l’industrie des colorants issus du goudron de houille ouvrit de nouveaux débouchés aux bichromates alcalins.
À partir de 1879, la chromite fut utilisée comme réfractaire pour les fours métallurgiques à sole basique, servant à fabriquer les aciers par le procédé Thomas et Gilchrist. En 1893, Moissan mit au point la réduction de l’oxyde de chrome par le charbon au four électrique et, en 1898, Goldschmidt découvrit la réduction aluminothermique de cet oxyde qui seule permit de préparer de grandes quantités de chrome pur.
À partir de 1907-1908, les industries des ferrochromes et des nichromes et, à partir de 1914, celle des Stellites (alliages à base de cobalt et de chrome) se développèrent et leur importance ne cesse de croître.
Enfin, le chromage des métaux, soit par électrolyse, soit par décomposition d’halogénures de chrome (II) vers 1 000 0C, a pris, depuis 1925, un essor considérable.
Minerais
On ne trouve pas de chrome à l’état natif, mais il est assez répandu sous forme de combinaisons. On évalue à 102 g/t son abondance moyenne dans la croûte terrestre.
L’oxyde de chrome (III) a l’état de traces colore certaines pierres précieuses: rubis, alexandrite, grenat.
Le tableau 1 renferme, suivant Udy, les minerais qui contiennent au moins 10 p. 100 de Cr23. Mais le minerai de beaucoup le plus important est la chromite, FeCr24 quand elle est pure, solide cristallisé brun qui appartient au groupe des spinelles; on l’appelle aussi fer chromé. Sa densité est voisine de 4,5 et son point de fusion varie de 1 545 à 1 850 0C.
Métallurgie
L’industrie prépare, outre le métal lui-même, les ferrochromes destinés à la sidérurgie. Des fontes contenant jusqu’à 70 p. 100 de chrome sont obtenues en réduisant la chromite par le charbon dans des fours électriques. Ces ferrochromes renferment de 0,02 à 10 p. 100 de carbone, suivant que le garnissage intérieur des fours est en chromite, en magnésite ou en graphite; on consomme environ 4 000 kWh par tonne de métal et la puissance optimale des fours est de 3 000 à 6 000 kW. Dans les fours Siemens-Martin, on obtient des ferrochromes à 30 à 40 p. 100 de chrome et 8 à 10 p. 100 de carbone.
Le chrome pur s’obtient en trois étapes: passage de la chromite à un bichromate alcalin; réduction de ce dernier par le soufre ou le charbon en oxyde Cr23; enfin réduction de l’oxyde à haute température par l’aluminium en poudre ou le silicium. Le chrome fondu se rassemble au fond du creuset et il est recouvert par l’alumine fondue, colorée en rouge par de l’oxyde de chrome; une seule opération peut fournir une centaine de kilogrammes de chrome titrant 99,5 p. 100. Les impuretés principales sont l’aluminium et le fer. La purification est difficile.
Un chrome plus pur peut être obtenu par électrolyse soit d’une solution d’acide chromique additionnée d’acide sulfurique ou de sulfate de chrome (III), soit d’une solution renfermant des sulfates de chrome (II), de chrome (III) et d’ammonium. Dans certaines usines, la cuve électrolytique est séparée en deux compartiments par un diaphragme poreux, et alimentée par une solution d’alun de chrome; le chrome électrolytique renferme toujours de l’hydrogène.
Le chromage électrolytique utilise des bains d’acide chromique additionnés d’acide sulfurique ou parfois d’acide fluorhydrique. Les anodes solubles en chrome ne conviennent pas, car le métal ne resterait pas à l’état d’oxydation 6 dans le bain; la température est maintenue constante: l’intensité de courant varie de 4 à 60 ampères par dm2. Pour obtenir un chromage brillant et de haute qualité, il faut d’abord nickeler. Un procédé plus ancien consiste à recouvrir le fer ou l’acier avec un mélange de chrome en poudre et d’alumine et à chauffer trois ou quatre heures vers 1 300-1 400 0C en atmosphère d’hydrogène. Le chromage du fer ou de l’acier peut être réalisé par action de la vapeur de chlorure de chrome (II) vers 900-1 000 0C:
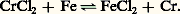
Signalons enfin l’immersion dans un bain de chlorures de sodium, de baryum et de chrome (II) fondus maintenu entre 900 et 1 200 0C.
Propriétés
Caractéristiques physiques et mécaniques
Le chrome est un métal blanc grisâtre, dur; par électrolyse, on obtient des dépôts brillants. Il existe plusieurs isotopes: 38, 48, 49, 50, 51, 52, 53, 54 et 55; les isotopes 49, 51 et 55 sont radioactifs. L’état électronique fondamental est 1s 2; 2s 2, 2p 6; 3s 2, 3p 6, 3d 5; 4s 1.
Les principales constantes physiques et mécaniques sont réunies dans le tableau 2.
Propriétés chimiques
À la température ordinaire, le chrome résiste à l’air sec ou humide, à l’eau de pluie ou à l’eau de mer et à divers agents chimiques; d’où l’intérêt du chromage. Il absorbe l’hydrogène, mais les hydrures déjà mentionnés sont des composés d’insertion.
Vers 600 0C, tous les halogènes, le fluorure et le chlorure d’hydrogène réagissent sur le chrome. Vers 2 000 0C, ce métal brûle dans l’oxygène en donnant l’oxyde Cr23; il décompose la vapeur d’eau au rouge vif; il est sulfuré par la vapeur de soufre à 700 0C et par l’hydrogène sulfuré à 1 200 0C. Le chrome fondu dissout jusqu’à 4 p. 100 de son poids d’azote; l’ammoniac, à 850 0C, donne un nitrure et l’oxyde NO, au rouge, un mélange de nitrure et d’oxyde.
À haute température, le chrome se combine avec le phosphore, le carbone, le silicium, le bore; on a fait intervenir dans le diagramme chrome-carbone les combinaisons Cr3C2, Cr7C2 et Cr23C6.
En solution aqueuse étendue, les hydracides halogénés, l’acide sulfurique et, plus difficilement, l’acide acétique attaquent le chrome à froid avec dégagement d’hydrogène et production d’un sel de chrome (II). L’acide sulfurique concentré et bouillant réagit avec dégagement d’anhydride sulfureux. À l’inverse, l’acide nitrique concentré, l’eau de chlore, les acides H3P4, HCl3, HCl4 rendent le chrome passif et, par conséquent, inattaquable par les acides étendus; on attribue cette passivité soit à une pellicule continue d’oxyde, soit à une adsorption d’oxygène; elle peut être détruite par action de l’hydrogène à chaud ou de divers réducteurs.
Les alcalis fondus attaquent le chrome au rouge, tandis que les carbonates alcalins sont sans action.
Le chrome pulvérisé catalyse certaines réactions: réduction de C2 en CO par l’hydrogène, réaction du méthane sur la vapeur de soufre avec production de sulfure de carbone, en particulier.
Propriétés physiologiques: toxicologie
Le métal lui-même n’est pas toxique, mais les sels de chrome trivalent et surtout l’acide chromique et ses sels sont des poisons. Les cations Cr3+ se fixent sur l’hémoglobine et les protéines du plasma. L’acide chromique, les bichromates et les chromates attaquent la peau et les voies respiratoires, provoquant des ulcères, des dermatoses, de l’irritation chronique, de graves lésions telles que la perforation de la cloison nasale. Pour l’homme, la dose mortelle de bichromate de potassium, poison méthémoglobinisant, est de 0,25 à 0,30 g. Les chromates jouissent de propriétés bactéricides.
Données analytiques
Les composés du chrome donnent, avec le borax, une perle verte. La fusion avec du carbonate de sodium au contact de l’air, ou mieux avec un nitrate alcalin, fournit une masse colorée en jaune par le chromate formé. En solution, les cations Cr3+ donnent avec les bases un précipité verdâtre d’oxyde Cr23 hydraté et ne précipitent pas par l’hydrogène sulfuré, alors que les chromates donnent une coloration violette avec la diphénylcarbazide, et, avec l’eau oxygénée, une coloration bleue, que l’on peut rassembler dans quelques gouttes d’éther. Dans ce dernier cas, les perchromates bleus contiennent du chrome à l’état d’oxydation 6.
Pour effectuer les dosages gravimétriques, le chrome est précipité, soit sous forme d’oxyde Cr23, soit sous forme de chromate de baryum BaCr4.
Pour un dosage volumétrique, on transforme d’abord par oxydation tout le chrome en chromate; on peut ensuite titrer par le sel de Mohr ou bien ajouter un mélange d’iodure de potassium et d’acide chlorhydrique étendu et doser au thiosulfate de sodium l’iode qui a été libéré.
Le dosage colorimétrique du chrome (VI) fait appel soit à la coloration jaune des chromates à pH déterminé, soit, de préférence, à la coloration violette avec la diphénylcarbazide.
Signalons encore des méthodes de dosage potentiométrique, polarographique, spectrographique et radiochimique; dans ce dernier cas, le chrome est précipité sous forme de chromate d’argent, puis on active l’argent par des neutrons thermiques.
Composés du chrome
Le chrome possède trois degrés d’oxydation (ou états de valence) principaux: + 2 auquel correspondent les sels chromeux, réducteurs énergiques, + 3 que l’on rencontre dans de nombreux sels et complexes chromiques et dans les chromites et + 6 qui est représenté par des oxydants, les chromates et les polychromates.
Il faut cependant signaler cinq états d’oxydation inhabituels: face=F0019 漣 2 dans l’hydrure de chrome carbonyle H2[Cr(CO)5], 0 dans le chrome hexacarbonyle Cr(CO)6 à structure octaédrique ou dans le chrome dibenzène Cr(C6H6)2 qui a une structure en sandwich, + 1 dans le perchlorate de chrome bis- 見, 見 -dipyridyle, + 4 dans l’oxyde Cr2, dans K2[Cr6] ou dans Ba2[Cr4], + 5 dans K2[CrOCl5] ou dans Na3Cr4.
Sels chromeux
Les sels de chrome (II), ou sels chromeux, sont préparés en attaquant le métal par un acide non oxydant, à l’abri de l’air, ou bien par double décomposition à partir du chlorure ou du sulfate; ils sont paramagnétiques et absorbent rapidement l’oxygène de l’air. Citons: l’oxyde CrO; l’hydroxyde Cr(OH)2, jaune; les halogénures Cr2 et CrCl2 ainsi que CrCl2,4 H2O; le sulfite CrS3,7 H2O, bleu, isomorphe du sulfate ferreux heptahydraté; l’acétate [Cr(OCOCH3)2]2,2 H2O, dimère, diamagnétique, plus stable, rouge.
Sels chromiques
Les sels de chrome (III) résultent de l’oxydation des sels chromeux ou de la réduction des chromates en milieu acide. Ils sont stables à l’air, paramagnétiques et donnent un très grand nombre de complexes hexacoordinés qui possèdent eux aussi trois électrons célibataires (d’où un moment magnétique voisin de 3,87 magnétons de Bohr).
Le sesquioxyde Cr23 provient de la réduction d’un bichromate alcalin par le soufre, la sciure de bois ou divers composés organiques, le toluène en particulier. On peut aussi calciner l’hydroxyde Cr(OH)3, précipité vert qui est en réalité un oxyde hydraté et non un hydroxyde. Cr23 est rhomboédrique, vert foncé; c’est un oxyde amphotère qui se dissout dans les acides en donnant les sels de chrome (III) et qui réagit à chaud sur les oxydes métalliques en fournissant des chromites; parmi ces dernières, citons la chromite de fer, cristaux cubiques du type spinelle; on peut obtenir certaines chromites en solution, mais elles sont généralement très hydrolysables.
En solution, les ions Cr3+ ont tendance à se dissimuler dans les structures complexes: soit dans des anions, comme le fer et l’aluminium; soit dans des cations, comme le cobalt ou le platine. La série des chromiammines, par exemple, est analogue à celle des cobaltiammines. La coordination est presque toujours égale à 6 et la structure octaédrique.
L’ion [Cr(H2O)6]3+ est violet et on le trouve dans les solutions aqueuses ou dans les sels chromiques hydratés. Les sels violets solides chauffés deviennent verts; leurs solutions aqueuses présentent le même virage et refusent alors de cristalliser. Ce changement de coloration est lié à l’introduction d’anions dans l’ion complexe avec expulsion d’une partie des molécules d’eau, et il est généralement réversible. On connaît par exemple les trois chlorures: [Cr(H2O)6]Cl3, violet (Recoura, 1886); [CrCl(H2O)5]Cl2,H2O, vert clair (Bjerrum, 1906); [CrCl2(H2O)4]Cl, 2 H2O, vert foncé (Recoura, 1886).
On a préparé aussi des complexes M2[Cr(H2O)Cl5] rouges ou violets et M3[CrCl6] violets, M étant un alcalin.
Citons comme sels chromiques:
– les halogénures: CrF3 vert et [Cr(H26]3 violet, CrCl3 couleur «fleur de pêcher» sublimable vers 1 100 0C et [Cr(H2O)6]Cl3 violet, CrBr3 et [Cr(H2O)6]Br3, [Cr(H2O)6]I3, 3H2O;
– le sulfate anhydre Cr2(SO4)3 rouge bleuâtre insoluble dans l’eau et l’hydrate Cr2(SO4)3,17 H2O violet, formulé aussi [Cr(H2O)6]2(SO4)3,5 H2O, obtenu en dissolvant l’oxyde hydraté dans l’acide sulfurique étendu; à 90 0C, ce sulfate violet donne un complexe vert hexahydraté formulé [Cr2(H2O)6(SO4)3]; à froid, les solutions vertes virent très lentement au violet; le sulfate de chrome (III) donne des aluns MCr(SO4)2, 12 H2O avec: M = Na, K, Rb, Cs, NH4, Tl(I), colorés en violet; on connaît les sels d’anions mono-, di-, et trichromisulfuriques [Cr2(H2O)4(SO4)4]2-, [Cr2(H2O)2(SO4)5]4- et [Cr2(SO4)6]6-;
– le nitrate [Cr(H2O)6](NO3)3,3H2O, violet;
– le phosphate [Cr(H2O)6]P4 obtenu par précipitation sous forme de cristaux tricliniques violets qui, calcinés, donnent le phosphate anhydre, rougeâtre, insoluble.
Les chromates
Le degré d’oxydation + 6 se rencontre essentiellement dans l’anhydride chromique ou trioxyde de chrome Cr3 et ses dérivés, les chromates et les polychromates; ces sels contiennent l’anion [Crn 3n+ ]2- avec n = 1, 2, 3 et 4. En solution aqueuse étendue, les acides minéraux forts permettent de passer facilement des chromates aux bichromates:
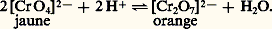
En l’absence d’acide, il y a hydrolyse:

On prépare l’anhydride chromique par action de l’acide sulfurique en excès sur une solution aqueuse très concentrée de bichromate de sodium ou de potassium; industriellement, on peut traiter par ce même acide la chromite naturelle puis effectuer une oxydation anodique. C’est un solide rouge foncé, à reflets violets, en aiguilles orthorhombiques; il fond à 197 0C et se décompose à partir de cette température; il est très soluble dans l’eau; c’est un anhydride d’acide et un oxydant extrêmement énergique. Ni l’acide chromique ni les acides polychromiques n’ont été isolés; mais on connaît leurs sels. Le chlorure d’acide est le chlorure de chromyle Cr2Cl2, liquide rouge foncé qui est un oxydant et un chlorurant énergique. Il existe des chlorochromates tels que 2Cr(Cl)OK.
Les chromates sont préparés soit par fusion oxydante de la chromite naturelle ou des composés du chrome trivalent, soit par oxydation de ces derniers en solution. Tous sont jaunes, à l’exception du chromate d’argent qui est rouge brique. Sont insolubles dans l’eau les chromates de calcium, de strontium, de mercure, d’argent, de baryum, de plomb; les trois derniers sont utilisés en gravimétrie.
Le chromate de sodium Na2Cr4, jaune, se présente en cristaux rhombiques bipyramidaux isomorphes avec ceux de Na2S4; il donne des hydrates à 4, 6 et 10 H2O et il est très soluble dans l’eau.
Le chromate de potassium jaune anhydre est isomorphe avec le sulfate.
Les bichromates sont obtenus soit en acidifiant les solutions de chromates, soit par oxydation des composés du chrome (III) en milieu acide. Le bichromate de sodium Na2Cr27,2H2O se prépare à partir des minerais; orangé, il se présente en prismes monocliniques hygroscopiques, très solubles dans l’eau. Par double décomposition avec les solutions de chlorure de potassium, il fournit le bichromate de potassium K2Cr27, qui cristallise, anhydre, sous forme de cristaux de couleur orangée, tricliniques, fondant à 398 0C, moins solubles que ceux du bichromate de sodium. Ces deux bichromates sont utilisés souvent dans l’industrie comme oxydants.
Usages
Le métal pur sert à recouvrir pour les protéger le fer, les aciers, le cuivre et divers alliages: c’est l’opération du chromage qui donne une surface brillante susceptible d’un beau poli, résistant bien à la corrosion. Il entre dans la composition d’aciers spéciaux et de nombreux alliages.
On utilise pour la construction mécanique des aciers contenant un faible pourcentage de chrome et de nickel; des proportions plus élevées conduisent à des aciers inoxydables, par exemple avec 18 p. 100 de chrome et 8 p. 100 de nickel. En augmentant encore les doses de nickel et de chrome, on obtient des aciers résistant à des températures de 650 à 1 150 0C; c’est le cas de l’Inconel qui contient 15 p. 100 de Cr, 78 p. 100 de Ni et 7 p. 100 de Fe.
Le Chromel (80 p. 100 de Ni et 20 p. 100 de Cr) sert à faire des résistances chauffantes et des couples thermo-électriques; il fait partie des nichromes.
Divers alliages à base de cobalt constituent les Stellites qui permettent le travail mécanique à chaud; à côté du cobalt, on y trouve du chrome, du tungstène, du molybdène, parfois du fer et du nickel, avec 1 à 2,5 p. 100 de carbone (exemple: 55 p. 100 de Co, 25 p. 100 de W, 15 p. 100 de Cr, 5 p. 100 de Mo).
Citons encore des alliages pour aimants permanents et le Vitallium (65 p. 100 de Co, 30 p. 100 de Cr, 5 p. 100 de Mo) utilisé par les dentistes et les chirurgiens car il est bien toléré par l’organisme.
La chromite seule ou additionnée de magnésite ou d’alumine sert à fabriquer des briques réfractaires pour les fours industriels à revêtement intérieur basique.
Le lactate et divers autres sels de chrome (III) servent de mordants en teinture, tandis que les chromates jouent le rôle d’oxydants et de mordants.
Un sulfate basique de chrome (III), vert foncé, sert au tannage des cuirs.
La gélatine bichromatée, qui, sous l’action de la lumière, devient insoluble dans l’eau chaude est utilisée en photographie.
Les bichromates dissous en milieu acide servent comme oxydants dans diverses industries organiques; on les régénère alors en soumettant à une oxydation anodique les sels de chrome (III) formés.
Enfin, pour fabriquer des peintures, on utilise comme pigments: l’oxyde de chrome (III) Cr23, vert plus ou moins foncé (le vert Guignet a pour formule Cr23,2 H2O); divers chromates et en particulier celui du plomb (jaune de chrome, orangé de chrome) et celui du zinc (le jaune de zinc est formé de chromates basiques de zinc ou de zinc et de potassium plus ou moins hydratés).
Signalons enfin l’emploi des bichromates comme dépolarisants dans certaines piles et leur utilisation pour fabriquer certaines poudres ainsi que quelques explosifs.
chrome [ krom ] n. m.
• 1797; lat. chroma, par le gr. khrôma « couleur », à cause de ses composés diversement colorés
1 ♦ Élément atomique (Cr; no at. 24; m. at. 51,99), métal du groupe du molybdène et du tungstène, brillant et dur. Acier au chrome (inoxydable). Sel de chrome. ⇒ chromate. Oxyde de chrome. ⇒ chromite. Alun de chrome (utilisé en tannerie). Jaune, rouge, brun de chrome : oxydes utilisés en teinture.
2 ♦ Pièce métallique en acier chromé (spécialt dans la carrosserie d'une automobile). Faire briller les chromes de sa voiture.
● chrome nom masculin (grec khrôma, couleur) Métal blanc, analogue au fer et au manganèse. (Élément chimique de symbole Cr.) Nombre atomique : 24 Masse atomique : 51,996 Masse volumique : 7,2 g°cm3 Température de fusion : 1 857 ± 20 °C Oligoélément métallique nécessaire à l'organisme dans diverses réactions biochimiques : métabolisme des glucides et des lipides principalement. ● chrome (difficultés) nom masculin (grec khrôma, couleur) Orthographe Pas d'accent circonflexe sur le o malgré sa prononciation fermée : [&ph95;ʀ&ph99;&ph97;], comme dans atome.
chrome
n. m. élément métallique (symbole Cr), de numéro atomique Z = 24.
⇒CHROME, subst. masc.
CHIM. Métal blanc grisâtre, brillant, dur, inoxydable, de symbole Cr, utilisé notamment pour la protection d'autres métaux et pour la fabrication de divers alliages. Minerai de chrome. L'Anglais Harry Brearley obtint l'acier au chrome, donnant le jour aux couteaux inoxydables et s'attirant la reconnaissance des ménagères (P. ROUSSEAU, Hist. des techniques et des inventions, 1967, p. 304).
— P. méton.
♦ Accessoire en acier chromé. Les chromes d'une voiture. Les sièges en tube. Ces derniers surtout le révoltaient : laissons le chrome aux dentistes (H. BAZIN, Vipère au poing, 1948, p. 160).
♦ Composé du chrome. Cuir au chrome (J. BÉRARD, J. GOBILLIARD, Cuirs et peaux, 1947, p. 108); tannage au chrome (J. BÉRARD, J. GOBILLIARD, Cuirs et peaux, 1947, p. 108).
— PEINT. Jaune de chrome, ou abs., chrome. ,,Nom générique d'une série de couleurs dont les nuances varient du jaune verdâtre à l'orangé rouge et dont la réaction fondamentale de préparation est l'action d'un sel de plomb sur un chromate alcalin`` (DUVAL 1959). Synon. chromate de plomb. Ton fin pour demi-teinte d'or (...) Base, chrome le plus clair (E. DELACROIX, Journal, 1822-63, p. 413). Vous repiquez les lumières avec du jaune de chrome foncé (E. et J. DE GONCOURT, Manette Salomon, 1867, p. 421).
♦ [Emploi en appos.] Elle mignotait Céline, sa préférée, dont la tignasse jaune de chrome l'intéressait (HUYSMANS, Les Sœurs Vatard, 1879, p. 102).
Rem. Chrome entre comme second élément de composition dans la formation a) de termes de chimie : ferro-chrome, nichrome; b) d'adj. relatifs à la couleur  ) bi-chrome (cf. A. MEYNIER, Les Paysages agraires, 1958, p. 130), synon. de bicolore,
) bi-chrome (cf. A. MEYNIER, Les Paysages agraires, 1958, p. 130), synon. de bicolore,  ) polychrome. De plusieurs couleurs.
) polychrome. De plusieurs couleurs.
 ) bi-chrome (cf. A. MEYNIER, Les Paysages agraires, 1958, p. 130), synon. de bicolore,
) bi-chrome (cf. A. MEYNIER, Les Paysages agraires, 1958, p. 130), synon. de bicolore,  ) polychrome. De plusieurs couleurs.
) polychrome. De plusieurs couleurs.Prononc. et Orth. :[ ]. ,,On prononce encore [o] fermé long dans : chrome, monochrome, polychrome, chromosome, rhizome, hippodrome, home, prodrome, sodome, tome, vélodrome, où le o marque cependant une tendance à s'ouvrir`` (KAMM. 1964, p. 81; cf. aussi BUBEN 1935, § 27, FOUCHÉ Prononc. 1959, p. 53 et aussi brome). Ds Ac. 1835-1932. Étymol. et Hist. A. 1562 mus. crome « dièse » (MAURICE SCÈVE, Microcosme, L. II, p. 66 ds HUG.), repris en 1832 chrome (RAYMOND); considéré comme anc. de Ac. Compl. 1842 à GUÉRIN 1892. B. 1753 rhét. (Encyclop. t. 3). C. 1797 chim. (VAUQUELIN, J. des Mines, 34 [Messidor, an 5], 757 ds QUEM. : J'ai cru devoir adopter [...] le nom de chrôme [...] qui m'a été proposé par le citoyen Haüy). Empr. au gr.
]. ,,On prononce encore [o] fermé long dans : chrome, monochrome, polychrome, chromosome, rhizome, hippodrome, home, prodrome, sodome, tome, vélodrome, où le o marque cependant une tendance à s'ouvrir`` (KAMM. 1964, p. 81; cf. aussi BUBEN 1935, § 27, FOUCHÉ Prononc. 1959, p. 53 et aussi brome). Ds Ac. 1835-1932. Étymol. et Hist. A. 1562 mus. crome « dièse » (MAURICE SCÈVE, Microcosme, L. II, p. 66 ds HUG.), repris en 1832 chrome (RAYMOND); considéré comme anc. de Ac. Compl. 1842 à GUÉRIN 1892. B. 1753 rhét. (Encyclop. t. 3). C. 1797 chim. (VAUQUELIN, J. des Mines, 34 [Messidor, an 5], 757 ds QUEM. : J'ai cru devoir adopter [...] le nom de chrôme [...] qui m'a été proposé par le citoyen Haüy). Empr. au gr. « couleur du corps humain; couleur » au fig. domaine de la rhét. « coloris du style, figure, ornement du style », domaine de la mus. « modulation, mélodie, air; genre de composition où l'on procède par demi-tons, musique chromatique ». Pour A, v. chromatique2. Le chrome (C) a été ainsi nommé en raison des belles couleurs de ses composés (FEW t. 2, p. 657a). Fréq. abs. littér. :13.
« couleur du corps humain; couleur » au fig. domaine de la rhét. « coloris du style, figure, ornement du style », domaine de la mus. « modulation, mélodie, air; genre de composition où l'on procède par demi-tons, musique chromatique ». Pour A, v. chromatique2. Le chrome (C) a été ainsi nommé en raison des belles couleurs de ses composés (FEW t. 2, p. 657a). Fréq. abs. littér. :13.
 ]. ,,On prononce encore [o] fermé long dans : chrome, monochrome, polychrome, chromosome, rhizome, hippodrome, home, prodrome, sodome, tome, vélodrome, où le o marque cependant une tendance à s'ouvrir`` (KAMM. 1964, p. 81; cf. aussi BUBEN 1935, § 27, FOUCHÉ Prononc. 1959, p. 53 et aussi brome). Ds Ac. 1835-1932. Étymol. et Hist. A. 1562 mus. crome « dièse » (MAURICE SCÈVE, Microcosme, L. II, p. 66 ds HUG.), repris en 1832 chrome (RAYMOND); considéré comme anc. de Ac. Compl. 1842 à GUÉRIN 1892. B. 1753 rhét. (Encyclop. t. 3). C. 1797 chim. (VAUQUELIN, J. des Mines, 34 [Messidor, an 5], 757 ds QUEM. : J'ai cru devoir adopter [...] le nom de chrôme [...] qui m'a été proposé par le citoyen Haüy). Empr. au gr.
]. ,,On prononce encore [o] fermé long dans : chrome, monochrome, polychrome, chromosome, rhizome, hippodrome, home, prodrome, sodome, tome, vélodrome, où le o marque cependant une tendance à s'ouvrir`` (KAMM. 1964, p. 81; cf. aussi BUBEN 1935, § 27, FOUCHÉ Prononc. 1959, p. 53 et aussi brome). Ds Ac. 1835-1932. Étymol. et Hist. A. 1562 mus. crome « dièse » (MAURICE SCÈVE, Microcosme, L. II, p. 66 ds HUG.), repris en 1832 chrome (RAYMOND); considéré comme anc. de Ac. Compl. 1842 à GUÉRIN 1892. B. 1753 rhét. (Encyclop. t. 3). C. 1797 chim. (VAUQUELIN, J. des Mines, 34 [Messidor, an 5], 757 ds QUEM. : J'ai cru devoir adopter [...] le nom de chrôme [...] qui m'a été proposé par le citoyen Haüy). Empr. au gr. « couleur du corps humain; couleur » au fig. domaine de la rhét. « coloris du style, figure, ornement du style », domaine de la mus. « modulation, mélodie, air; genre de composition où l'on procède par demi-tons, musique chromatique ». Pour A, v. chromatique2. Le chrome (C) a été ainsi nommé en raison des belles couleurs de ses composés (FEW t. 2, p. 657a). Fréq. abs. littér. :13.
« couleur du corps humain; couleur » au fig. domaine de la rhét. « coloris du style, figure, ornement du style », domaine de la mus. « modulation, mélodie, air; genre de composition où l'on procède par demi-tons, musique chromatique ». Pour A, v. chromatique2. Le chrome (C) a été ainsi nommé en raison des belles couleurs de ses composés (FEW t. 2, p. 657a). Fréq. abs. littér. :13.DÉR. 1. Chromate, subst. masc. Sel de l'acide chromique. Elle a les cheveux couleur chromate de plomb (HUGO, Les Misérables, t. 2, 1862, p. 329). — [ ]. Ds Ac. 1835-1932. — 1re attest. 1797 (Vauquelin ds Annales de chimie, XXVII, 19 ds DG); de chrome, suff. -ate. — Fréq. abs. littér. : 1. 2. Chromifère, adj. Qui contient du chrome. Grenat chromifère (A. DE LAPPARENT, Cours de minér., 1899, p. 485). — Seule transcr. ds LITTRÉ : kro-mi-fè-r'. — 1re attest. 1838 (Ac. Compl. 1842); de chrome, suff. -fère. 3. Chromique, adj. a) Qui concerne le chrome trivalent. Les propriétés tannantes (...) varient (...) suivant la nature du sel chromique employé (J. BÉRARD, J. GOBILLIARD, Cuirs et peaux, 1947, p. 84). b) Relatif aux composés oxygénés du chrome hexavalent. Acide chromique (J. ROSTAND, La Genèse de la vie, 1943, p. 156). Anhydride chromique. Synon. trioxyde de chrome (cf. DUVAL 1959). — [
]. Ds Ac. 1835-1932. — 1re attest. 1797 (Vauquelin ds Annales de chimie, XXVII, 19 ds DG); de chrome, suff. -ate. — Fréq. abs. littér. : 1. 2. Chromifère, adj. Qui contient du chrome. Grenat chromifère (A. DE LAPPARENT, Cours de minér., 1899, p. 485). — Seule transcr. ds LITTRÉ : kro-mi-fè-r'. — 1re attest. 1838 (Ac. Compl. 1842); de chrome, suff. -fère. 3. Chromique, adj. a) Qui concerne le chrome trivalent. Les propriétés tannantes (...) varient (...) suivant la nature du sel chromique employé (J. BÉRARD, J. GOBILLIARD, Cuirs et peaux, 1947, p. 84). b) Relatif aux composés oxygénés du chrome hexavalent. Acide chromique (J. ROSTAND, La Genèse de la vie, 1943, p. 156). Anhydride chromique. Synon. trioxyde de chrome (cf. DUVAL 1959). — [ ]. Ds Ac. 1835-1932. — 1re attest. 1797 chim. (Vauquelin ds Annales de chimie, XXVII, 15 ds DG); de chrome, suff. -ique. — Fréq. abs. littér. : 1. 4. Chromite, subst. fém. Minerai de chrome. Synon. fer chromé (cf. A. DE LAPPARENT, Cours de minér., 1899, p. 550). — 1re attest. 1830 (BEUDANT, p. 458); de chrome, suff. -ite.
]. Ds Ac. 1835-1932. — 1re attest. 1797 chim. (Vauquelin ds Annales de chimie, XXVII, 15 ds DG); de chrome, suff. -ique. — Fréq. abs. littér. : 1. 4. Chromite, subst. fém. Minerai de chrome. Synon. fer chromé (cf. A. DE LAPPARENT, Cours de minér., 1899, p. 550). — 1re attest. 1830 (BEUDANT, p. 458); de chrome, suff. -ite.
 ]. Ds Ac. 1835-1932. — 1re attest. 1797 (Vauquelin ds Annales de chimie, XXVII, 19 ds DG); de chrome, suff. -ate. — Fréq. abs. littér. : 1. 2. Chromifère, adj. Qui contient du chrome. Grenat chromifère (A. DE LAPPARENT, Cours de minér., 1899, p. 485). — Seule transcr. ds LITTRÉ : kro-mi-fè-r'. — 1re attest. 1838 (Ac. Compl. 1842); de chrome, suff. -fère. 3. Chromique, adj. a) Qui concerne le chrome trivalent. Les propriétés tannantes (...) varient (...) suivant la nature du sel chromique employé (J. BÉRARD, J. GOBILLIARD, Cuirs et peaux, 1947, p. 84). b) Relatif aux composés oxygénés du chrome hexavalent. Acide chromique (J. ROSTAND, La Genèse de la vie, 1943, p. 156). Anhydride chromique. Synon. trioxyde de chrome (cf. DUVAL 1959). — [
]. Ds Ac. 1835-1932. — 1re attest. 1797 (Vauquelin ds Annales de chimie, XXVII, 19 ds DG); de chrome, suff. -ate. — Fréq. abs. littér. : 1. 2. Chromifère, adj. Qui contient du chrome. Grenat chromifère (A. DE LAPPARENT, Cours de minér., 1899, p. 485). — Seule transcr. ds LITTRÉ : kro-mi-fè-r'. — 1re attest. 1838 (Ac. Compl. 1842); de chrome, suff. -fère. 3. Chromique, adj. a) Qui concerne le chrome trivalent. Les propriétés tannantes (...) varient (...) suivant la nature du sel chromique employé (J. BÉRARD, J. GOBILLIARD, Cuirs et peaux, 1947, p. 84). b) Relatif aux composés oxygénés du chrome hexavalent. Acide chromique (J. ROSTAND, La Genèse de la vie, 1943, p. 156). Anhydride chromique. Synon. trioxyde de chrome (cf. DUVAL 1959). — [ ]. Ds Ac. 1835-1932. — 1re attest. 1797 chim. (Vauquelin ds Annales de chimie, XXVII, 15 ds DG); de chrome, suff. -ique. — Fréq. abs. littér. : 1. 4. Chromite, subst. fém. Minerai de chrome. Synon. fer chromé (cf. A. DE LAPPARENT, Cours de minér., 1899, p. 550). — 1re attest. 1830 (BEUDANT, p. 458); de chrome, suff. -ite.
]. Ds Ac. 1835-1932. — 1re attest. 1797 chim. (Vauquelin ds Annales de chimie, XXVII, 15 ds DG); de chrome, suff. -ique. — Fréq. abs. littér. : 1. 4. Chromite, subst. fém. Minerai de chrome. Synon. fer chromé (cf. A. DE LAPPARENT, Cours de minér., 1899, p. 550). — 1re attest. 1830 (BEUDANT, p. 458); de chrome, suff. -ite.BBG. — Appellations trompeuses. Vie Lang. 1971, pp. 220-221.
chrome [kʀom] n. m.
ÉTYM. 1797, Vauquelin; crome (mus.) « dièse », 1562; empr. au grec khrôma « couleur », à cause des composés très colorés du métal.
❖
1 Métal gris, brillant, très dur (symb. Cr; no at. 24; p. at. 51,996; dens. 7,18 à 7,20; temp. de fusion 1 890 °C). || On obtient le chrome par réduction de l'oxyde par l'aluminium. || Minerais contenant du chrome : fer chromé ou chromite; chromate de plomb (jaune de chrome). || Composés oxygénés du chrome : protoxyde, oxyde de chrome; sesquioxyde de chrome (utilisé dans la fabrication de colorants pour la porcelaine); anhydride chromique. || Les hydrates de chrome donnent des colorants (vert de chrome…). || Sels de chrome. ⇒ Chromate (sels oxygénés : sels chromeux, sels chromiques). || Alliages au chrome : fer, chrome, charbon (ferrochrome); fer, nickel, chrome (nichrome); aciers au chrome (aciers inoxydables). || Le chrome peut prendre un très beau poli. || Le chrome sert de catalyseur dans de nombreuses réactions.
♦ Loc. || Rouge, brun de chrome. || Alun de chrome, utilisé en teinture, tannerie.
2 Pièce métallique en acier chromé (spécialt, dans la carrosserie d'une automobile). || Nettoyer les chromes de sa voiture.
0 De fait nous avons un peu vagué autour (de la voiture), plutôt pour ne pas nous attraper, tandis que sans rien voir elle cajolait les chromes !
Maurice Clavel, le Tiers des étoiles, p. 172.
❖
DÉR. Chromate, chromer, chromique.
COMP. Ferrochrome, nichrome.
Encyclopédie Universelle. 2012.